ლითიუმი
| ლითიუმი |
| 3Li |
| 6.94 |
| 2s1 |
 | ||||||||||||||||||
| ზოგადი თვისებები | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | მოვერცხლისფრო-მოთეთრო, რბილი და მსუბუქი ლითონი | |||||||||||||||||
| სტანდ. ატომური წონა Ar°(Li) |
[6.938, 6.997][1] 6.94±0.06[2] (დამრგვალებული) | |||||||||||||||||
| ლითიუმი პერიოდულ სისტემაში | ||||||||||||||||||
| ||||||||||||||||||
| ატომური ნომერი (Z) | 3 | |||||||||||||||||
| ჯგუფი | 1 ჯგუფი (ტუტე ლითონები) | |||||||||||||||||
| პერიოდი | 2 პერიოდი | |||||||||||||||||
| ბლოკი |
| |||||||||||||||||
| ელექტრონული კონფიგურაცია | [He] 2s1 | |||||||||||||||||
| ელექტრონი გარსზე | 2, 1 | |||||||||||||||||
ელემენტის ატომის სქემა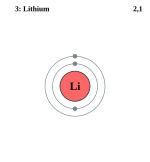 | ||||||||||||||||||
| ფიზიკური თვისებები | ||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | |||||||||||||||||
| დნობის ტემპერატურა |
180.50 °C (453.65 K, 356.90 °F) | |||||||||||||||||
| დუღილის ტემპერატურა |
1330 °C (1603 K, 2426 °F) | |||||||||||||||||
| სიმკვრივე (ო.ტ.) | 0.534 გ/სმ3 | |||||||||||||||||
| სიმკვრივე (ლ.წ.) | 0.512 გ/სმ3 | |||||||||||||||||
| კრიტიკული წერტილი | 3220 K, 67 მპა | |||||||||||||||||
| დნობის კუთ. სითბო | 3.00 კჯ/მოლი | |||||||||||||||||
| აორთქ. კუთ. სითბო | 136 კჯ/მოლი | |||||||||||||||||
| მოლური თბოტევადობა | 24.860 ჯ/(მოლი·K) | |||||||||||||||||
ნაჯერი ორთქლის წნევა
| ||||||||||||||||||
| ატომის თვისებები | ||||||||||||||||||
| ჟანგვის ხარისხი | +1 (a strongly basic oxide) | |||||||||||||||||
| ელექტროდული პოტენციალი |
−3.06 ვ | |||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 0.98 | |||||||||||||||||
| იონიზაციის ენერგია |
| |||||||||||||||||
| ატომის რადიუსი | ემპირიული: 152 პმ | |||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 128±7 პმ | |||||||||||||||||
| იონური რადიუსი (rion) |
68 (+1e) პმ | |||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 182 პმ | |||||||||||||||||
|
ლითიუმის სპექტრალური ზოლები | ||||||||||||||||||
| სხვა თვისებები | ||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | |||||||||||||||||
| მესრის სტრუქტურა |
კუბური მოცულობაცენტრირებული  | |||||||||||||||||
| მესრის პერიოდი | 3.490 Å | |||||||||||||||||
| ბგერის სიჩქარე | 6000 მ/წმ | |||||||||||||||||
| თერმული გაფართოება | 46 µმ/(მ·K) | |||||||||||||||||
| ხვედრითი თბოტევადობა | 3.489 ჯ/(K·მოლ) | |||||||||||||||||
| თბოგამტარობა | 84.8 ვტ/(მ·K) | |||||||||||||||||
| კუთრი წინაღობა | 92.8 ნომ·მ (20 °C) | |||||||||||||||||
| მაგნეტიზმი | პარამაგნეტიკი | |||||||||||||||||
| მაგნიტური ამთვისებლობა | +14.2×10−6 სმ3/მოლ | |||||||||||||||||
| იუნგას მოდული | 4.9 გპა | |||||||||||||||||
| წანაცვლების მოდული | 4.2 გპა | |||||||||||||||||
| დრეკადობის მოდული | 11 გპა | |||||||||||||||||
| მოოსის მეთოდი | 0.6 | |||||||||||||||||
| ბრინელის მეთოდი | 5 მპა | |||||||||||||||||
| CAS ნომერი | 7439-93-2 | |||||||||||||||||
| ისტორია | ||||||||||||||||||
| აღმომჩენია | იოჰან ავგუსტ არფვედსონი (1817) | |||||||||||||||||
| პირველი მიმღებია | ჰამფრი დეივი (1818) | |||||||||||||||||
| ლითიუმის მთავარი იზოტოპები | ||||||||||||||||||
| ||||||||||||||||||
| • | ||||||||||||||||||
ლითიუმი[3][4] (ლათ. Lithium < ძვ. ბერძნ. λίθος [lithos] — „ქვა“; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეორე პერიოდის, პირველი ჯგუფის (მოძველებული კლასიფიკაციით — პირველი ჯგუფის მთავარი ქვეჯგუფის, Iა) ქიმიური ელემენტი. მისი ატომური ნომერია 3, ატომური მასა — 6.94, tდნ — 180.50 °C, tდუღ — 1330 °C, სიმკვრივე — 0.534 გ/სმ3; ლითიუმი მოვერცხლისფრო-მოთეთრო, რბილი, პლასტიკური და მსუბუქი ლითონია; ბუნებრივი ლითიუმი შედგება ორი სტაბილური იზოტოპისაგან: (7.59 %) და (92.41 %)[2]. ხელოვნური გზით მიღებულია ლითიუმის არამდგრადი ნუკლიდები, რომელთა მასური რიცხვი მერყეობს 3-13-ის შუალედში; მიეკუთვნება ტუტე ლითონებს.
აღმოჩენის ისტორია[რედაქტირება | წყაროს რედაქტირება]
აღმოჩენილია 1817 წელს შვედი ქიმიკოსის ი. არფვედსონის მიერ პეტალიტის მინერალში, ხოლო ლითონური ლითიუმი პირველად მიიღო ინგლისელმა ქიმიკოსმა ჰ. დეივიმ 1818 წელს.
დედამიწის ქერქში საკმაოდ გავრცელბული ელემენტია. მისი შემცველობაა მასის მიხედვით 3.2×10−3 %. ცნობილია ლითიუმის მრავალი მინერალი. ლითიუმი ყველაზე ცნობილ ნაერთში ერთვალენტოვანია. ჰაერზე გახურებისას ან ჟანგბადთან ურთიერთქმედების შედეგად იწვის და წარმოქმნის ჟანგს . სხვა ტუტე ლითონთან შედარებით ლითიუმი წყალთან ნაკლებ ენერგიულად ურთიერთქმედებს. ამ დროს წარმოიქმნება ჰიდროჟანგი და წყალბადი. მინერალური მჟავები ლითიუმს ადვილად ხსნის.
იზოტოპები[რედაქტირება | წყაროს რედაქტირება]
ლითიუმი ბუნებაში გავრცელებული ელემენტია. მისი ატომური მასა მერყეობს 6.938-6.997 შორის[1] (სხვა ცნობით — 6.9387-6.9959 შორის[2]) და გვხვდება მისი ორი სტაბილური იზოტოპის და სახით. (საშუალო ატომური მასა — 6.01512289), მისი ხვედრითი წილი ბუნებრივ ლითიუმში ვარირებს 1.9-7.8 % შორის, ხოლო (საშუალო ატომური მასა — 7.016 003 44), კი — 92.2-98.1 %. მეცნიერებმა ბუნებაში წყალსა და ხმელეთში ლითიუმის ორივე იზოტოპის ატომური მასების შეჯამების შედეგად დაადგინეს, რომ ბუნებრივ ლითიუმში შედგებოდა 7.59 %, ხოლო — 92.41 %[2].
სტანდარტული ატომური მასა[რედაქტირება | წყაროს რედაქტირება]
ლითიუმის სტანდარტული ატომური მასად მიღებულია — 6.94 (6.940037), რომელიც როგორც წესი იანგარიშება ბუნებაში არსებულ ყველა სტაბილურ და შედარებით მდგრად იზოტოპტთა საშუალო შეწონილი ატომური მასით, მათი დედამიწის ქერქსა და ატმოსფეროში გავრცელების პროპორციულად.
| იზოტოპი | Z | N | ატომური მასა (მ.ა.ე.) |
% ბუნებაში | საშუალო შეწონილი |
|---|---|---|---|---|---|
| 6Li | 3 | 3 | 6.015122795(16) | 7.59 %[2] | 0.456547 |
| 7Li | 3 | 4 | 7.01600455(8) | 92.41 %[2] | 6.483489 |
| Ar°(Li) | 6.940037 |
ლითიუმი ჰალოგენებთან ურთიერთქმედებისას წარმოქმნის ჰალოგენიდებს (მაგალითად ლითიუმქლორიდი), გოგირდთან გახურებისას — სულფიდს , ხოლო წყალბადთან — ლითიუმის ჰიდრიდს, აზოტთან 250 °C-ზე წარმოქმნის ნიტრიდს , ფოსფორთან უშუალოდ არ ურთიერთქმედებს. ლითიუმის ნახშირბადთან გახურებისას მიიღება კარბიდი , სილიციუმთან — სილიციდი.
ლითიუმის წარმოქმნის მრავალრიცხოვან ლითიუმორგანულ ნაერთს, რაც განაპირობებს მის დიდ როლს ორგანულ სინთეზში. ლითონების ერთ ნაწილთან (, , ) წარმოქმნის მყარ ხსნარებს, ზოგიერთთან — ლითონთშორის ნაერთებს (, ).
ლითიუმის ნაერთებს ძირითადად ღებულობენ ლითიუმის შემცველი მადნების გამდიდრებით და მიღებული კონცენტრატების ჰიდრომეტალურგიული გადამუშავებით. ძირითად სილიკატურ მინერალს — სპოდუმენს — ამუშავებენ სულფატური, გოგირდმჟავური და სხვა მეთოდებით.
ლითონურ ლითიუმს ღებულობენ ლითიუმისა და კალიუმის ქლორიდების ნარევის ნალღობის ელექტროლიზით 400-460 °C (კომპონენტების წონითი შეფარდებაა 1:1).
ლითიუმს ძირითადად ბირთვულ ენერგეტიკაში იყენებენ. ლითიუმის იზოტოპი ერთადერთი საწარმოო ნედლეულია ტრიტიუმის წარმოებისათვის. თხევად ლითიუმს იყენებენ თბოგადამტანად ურანულ რეაქტორებში, ლითიუმის ნაერთებს კი — სილიკატურ მრეწველობაში, პლასტიკური საცხების მისაღებად და სხვა. ფართოდ არის ცნობილი ლითიუმის შემცველი ალუმინის შენადნობები (აერონი და სკლერონი), რომლებსაც სიმსუბუქის, სიმტკიცის, პლასტიკურობისა და კოროზიამედეგობის გამო ავიამშენებლობაში იყენებენ. ლითიუმი ერთ-ერთი უმნიშვნელოვანესი იშვიათი ელემენტია.
გამოყენების სხვა სფეროები[რედაქტირება | წყაროს რედაქტირება]
ელექტრული და ელექტრონული მოწყობილობები: ლითიუმი გამოიყენება ლითიუმის ბატარეების დამზადებისას ანოდად. ასევე შექმნილია ბატარეები, რომელიც შეიცავენ ლითიუმის იონს. ცნობილია ლითიუმ-რკინის ფოსფორბატარეები და ნანომეტრული ბატარეები. ლითიუმის ნიობატი (ნიობიის მჟავას მარილი) გამოიყენება ტელეკომუნიკაციების საშუალებებში, როგორიცაა მობილური ტელეფონები და ოპტიკური მოდულატორები.
ქიმიური გამოყენების სფერო[რედაქტირება | წყაროს რედაქტირება]
ლითიუმის ქლორიდი და ლითიუმის ბრომიდი ძლიერ ჰიგროსკოპული არიან და გამოიყენებიან როგორც გამომშრობი საშუალება. ლითიუმის შენალღობი ალუმინთან, კალიუმთან, სპილენძთან და მაგნიუმთან გამოიყენება გამძლე მასალების დასამზადებლად. ლითიუმი გამოიყენება, როგორც მაღალტემპერატურული საპოხი ნივთიერება. ბოლო წლებში განსაკუთრებით გაიზარდა მისი მნიშვნელობა ატომგულურ ენერგეტიკაში, როგორც ძვირფასი ნედლეული თერმობირთვული პროცესებისათვის. მეტალური ლითიუმი გამოიყენება ორგანოლითიუმის ნაერთების მოსამზადებლად. ლითიუმორგანული ნაერთები შეიცავენ Li-C კავშირს და გამოიყენება ორგანულ სინთეზებში გრინიარის რეაგენტის შემცვლელად. ლითიუმი არის ოლეფინების პოლიმერიზაციის რეაქციებში კატალიზატორი. — ლითიუმალუმინიუმჰიდრიდი სელექციური კატალიზატორია ორგანულ სინთეზში. ლითიუმის სულ უმნიშვნელო რაოდენობა ლითონებს ანიჭებს მნიშვნელოვან სიმაგრეს, ამცირებს მათ სიმყიფეს და გაფართოების კოეფიციენტს. ლითიუმ-კალციუმის შენადნობები იხმარება შავ მეტალურგიაში, კერძოდ უჟანგავი ფოლადისათვის.
ლიტერატურა[რედაქტირება | წყაროს რედაქტირება]
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.-Л.: Химия, 1970. — 407 с.
რესურსები ინტერნეტში[რედაქტირება | წყაროს რედაქტირება]
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
| პორტალი „ქიმია“ | |
| ლითიუმი ვიქსიკონში | |
| ლითიუმი ვიკისაწყობში |
| ქიმიურ ელემენტთა პერიოდული სისტემა | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| 8 | 119 | 120 | ⁂ | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 | ||||||||||
| ⁂ | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||














