ტექნეციუმი
| ტექნეციუმი |
| 43Tc |
| 97 |
| 4d5 5s2 |
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ზოგადი თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | მოვერცხლისფრო-რუხი ფერის კომპაქტური ლითონი | ||||||||||||||||||||||||||||||||||||||||||||||||||
| მასური რიცხვი | [97] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ტექნეციუმი პერიოდულ სისტემაში | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 43 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ჯგუფი | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| პერიოდი | 5 პერიოდი | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ბლოკი |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Kr] 4d5 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 13, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
ელემენტის ატომის სქემა | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | ||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის ტემპერატურა |
2157 °C (2430 K, 3915 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| დუღილის ტემპერატურა |
4265 °C (4538 K, 7709 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 11 გ/სმ3 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 33.29 კჯ/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 585.2 კჯ/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 24.27 ჯ/(მოლი·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −3, −1, 0, +1, +2, +3, +4, +5, +6, +7 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 1.9 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 136 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 147±7 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| იონური რადიუსი (rion) |
(+7e)56 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 205 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
ტექნეციუმის სპექტრალური ზოლები | |||||||||||||||||||||||||||||||||||||||||||||||||||
| სხვა თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | დაშლის შედეგად | ||||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა |
მჭიდრო ჰექსაგონალური | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 16 200 მ/წმ (20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| თერმული გაფართოება | 7.1 µმ/(მ·K) (25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ხვედრითი თბოტევადობა | 50.6 ჯ/(K·მოლ) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნეტიზმი | პარამაგნეტიკი | ||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | +270.0×10−6 სმ3/მოლ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS ნომერი | 7440-26-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ისტორია | |||||||||||||||||||||||||||||||||||||||||||||||||||
| სახელწოდება მომდინარეობს | ძვ. ბერძნ. τεχνητός [technētos] — „ხელოვნური“ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| იწინასწარმეტყველა | დიმიტრი მენდელეევი (1871) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| აღმომჩენი და პირველი მიმღებია | ემილიო სერგე და კარლო პერიე (1937) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ტექნეციუმის მთავარი იზოტოპები | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| • | |||||||||||||||||||||||||||||||||||||||||||||||||||
ტექნეციუმი[1][2] (ლათ. Technetium < ძვ. ბერძნ. τεχνητός [technētos] — „ხელოვნური“; ქიმიური სიმბოლო — ), ეკა-მანგანუმი — ელემენტთა პერიოდული სისტემის მეხუთე პერიოდის, მეშვიდე ჯგუფის (მოძველებული კლასიფიკაციით — მეშვიდე ჯგუფის თანაური ქვეჯგუფის, VIIბ) რადიოაქტიური ქიმიური ელემენტი. მისი ატომური ნომერია — 43, ატომური მასა — 98.9062, tდნ — 2140°C, tდუღ — 4700°C, სიმკვრივე — 11.5 გ/სმ3, მოვერცხლისფრო-რუხი ფერის კომპაქტური ლითონი. ტექნეციუმს სტაბილური იზოტოპები არა აქვს. რადიოაქტიური იზოტოპებიდან პრაქტიკული მნიშვნელობისაა ორი: (T1/2=2.12·105 წ) და (T1/2=6.04 სთ). ელემენტის არსებობა იწინასწარმეტყველა დ. მენდელეევმა. 1937 წელს ტექნეციუმი აღმოაჩინეს იტალიელმა მეცნიერებმა ე. სეგრემ და კ. პერიემ მოლიბდენის ბირთვის დეიტრონებით დაბომბვისას.
ისტორია[რედაქტირება | წყაროს რედაქტირება]
ტექნეციუმი ნაწინასწარმეტყველები ჰქონდა მენდელეევს, რომელმაც პერიოდულ სისტემაში გამოტოვა ადგილი უცნობი ელემენტისათვის, და უწოდა ეკა-მანგანუმი პერიოდულობის კანონის საფუძველზე. 1846 წლიდან, როდესაც ელემენტი იქნა «აღმოჩენილი» სახელწოდებით ილმენიუმი, პერიოდულად შეცდომით ხდებოდა 43-ე ელემენტის «აღმოჩენა» (როგორც ლუციუმი, ნიპონიუმი). თუმცა ბირთვული ფიზიკის განვითარებასთან ერთად ნათელი გახდა, თუ რატომ ვერ იქნა ბუნებაში ტექნიციუმი აღმოჩენილი: მატაუხი-შჩუკარევის აკრძალვის წესის შესაბამისად ამ ელემენტს არ გააჩნია სტაბილური იზოტოპები. ტექნიციუმი (ტექნეციუმ-37 იზოტოპი) სუფთა სახით გამოყოფილი იქნა 1937 წლის 13 ივლისს კ. პერიეს და ემილიო ჯინო სეგრეს მიერ, და გახდა პირველად ხელოვნურად მიღებული ელემენტი, საიდანაც წარმოდგა მისი სახელი ტექნიკური ანუ ხელოვნური.
სახელწოდების წარმომავლობა[რედაქტირება | წყაროს რედაქტირება]
სახელწოდება მოდის ძვ. ბერძნ. τεχνητός — ხელოვნური.
ბუნებაში[რედაქტირება | წყაროს რედაქტირება]
დედამიწაზე ტექნეციუმი გვხვდება ურანთან ერთად ძალიან მცირე კვალის სახით - რაოდენობით, 5×10−10 გრ - 1 კგ ურანზე. სპექტროსკოპიის მეთოდებით აღმოჩენილია ანდროიდისა და ვეშაპის თანავარსკვლავედის ზოგიერთი ვარსკვლავის სპექტრში.
მიღება[რედაქტირება | წყაროს რედაქტირება]
ტექნეციუმს იღებენ რადიოაქტიური ნარჩენებისაგან ქიმიური მეთოდით.
ამას გარდა, ტექნეციუმი წარმოიქმნება 232Th, 233U, 238U, 239Pu ნუკლიდების გაყოფისას და წელიწადის განმავლობაში რეაქტორებში შეიძლება კილოგრამობით დაგროვდეს.
ფიზიკური და ქიმიური თვისებები[რედაქტირება | წყაროს რედაქტირება]
ფიზიკური თვისებები[რედაქტირება | წყაროს რედაქტირება]
ტექნეციუმი — რადიოაქტიური გარდამავალი ლითონია, რომელიც მოვერცხლისფრო-რუხი ფერისაა და აქვს ჰექსაგონალური კრისტალური მესერი (a = 2,737 Å; с = 4,391 Å); თხელ ფენებში მას გააჩნია წახნაგცენტრირებული ფორმა. ის გარეგნულად ჰგავს პლატინას და იგი ჩვეულებრივ მიიღება მონაცისფრო ფხვნილის სახით. ატომური ტექნეციუმისათვის დამახასიათებელია გამოსხივების ზოლები შემდეგ ტალღის სიგრძეზე: 363.3 ნმ, 403.1 ნმ, 426.2 ნმ, 429.7 ნმ და 485.3 ნმ.
მისი მეტალური ფორმა (სუსტად) პარამაგნიტურია. სუფთა ლითონური ტექნეციუმის მონოკრისტალი ხდება ზეგამტარი 7.46 K ტემპერატურაზე დაბლა. ტექნეციუმის სიმკვრივე r = 11.480გ/სმ3, Tლღ = 2200 °C, Tდუღ = 4600 °C.
ქიმიური თვისებები[რედაქტირება | წყაროს რედაქტირება]
ქიმიური თვისებებით ტექნეციუმი ახლოსაა მანგანუმთან და რენიუმთან, რომელთაგან ტექნეციუმი უფრო ემსგავსება რენიუმს, განსაკუთრებით მისი ქიმიური ინერტულობით და ტენდენციით, წარმოქმნას კოვალენტური ბმები. მანგანუმისაგა განსხვავებით, ტექნეციუმი ადვილად არ წარმოქმნის კათიონს. ნაერთებში ავლენს −1-დან +7-მდე ჟანგვის ხარისხს. ჟანგბადთან ურთიერთქმედებისას წარმოქმნის ოქსიდებს Tc2O7 და TcO2, ქლორთან და ფთორთან — ჰალოგენიდებს TcX6, TcX5, TcX4, გოგირდთან — სულფიდებს Tc2S7 და TcS2. ტექნეციუმი შედის საკოორდინაციო და ელემენტოორგანული ნაერთების შემადგენლობაში. ლითონების რიგში ტექნეციუმი დგას წყალბადის მარჯვნივ, არ რეაგირებს მარილმჟავასთან, მაგრამ ადვილად იხსნება გოგირდმჟავაში და აზოტმჟავაში და სამეფო წყალში.
ჰიდრიდები და ოქსიდები[რედაქტირება | წყაროს რედაქტირება]
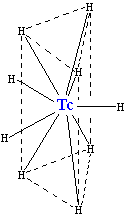
ტექნეციუმის ურთიერთქმედებით წყალბადთან, წარმოიქმნება უარყოფითად დამუხტული ჰიდრიდ იონი [TcH9]−2−, რომელსაც გააჩნია [ReH9]−2-ის მსგავსი კრისტალური სტრუქტურა, იგი წარმოადგენს ტრიგონალურ პრიზმს, რომლის ცენტრშიც მოთავსებულია ტექნეციუმის ატომი და კუთხეებში კი - ექვსი წყალბადის ატომი, დანარჩენი სამი წყალბადი წარმოქმნის სამკუთხედს, რომელიც კვეთს პრიზმას მის ცენტრში. ამ კონპლექსის კოორდინაციული რიცხვია 9 (იგულისხმება, რომ ტექნეციუმის ატომს აქვს ცხრა მეზობელი), რომელიც წარმოადგენს უმაღლესს ტექნეციუმის კომპლექსისათვის. კომპლექსში ორი წყალბადის ატომი შეიძლება ჩაინაცვლოს ნატრიუმის (Na+) ან კალიუმის (K+) იონებით.
ტექნეციუმის ლითონური ფორმა ჰაერზე მსუბუქად შავდება. მისი ფხვნილისებრი ფორმა იწვის ჟანგბადში. ცნობილია მისი ორი ოქსიდი: TcO2 და Tc2O7. დაჟანგვის პირობებში, როდესაც ატომები კარგავს ელექტრონებს, მიიღება ტექნეციუმ(VII), ტექნეცატ იონის -TcO−4 სახით.
400 – 450 °C ტემპერატურაზე ტექნეციუმის ოქსიდები წარმოქმნიან მკრთალ-ყვითელ ჰეპტოქსიდს.
- 4 Tc + 7 O2 → 2 Tc2O7
სადაც Tc-O ბმის სიგრძეა 167 -184 პიკომეტრი, ხოლო O-Tc-O კუთხე შეადგენს 180°.
ტექნეციუმ ჰეპტოქსიდი წარმოადგენს ნატრიუმის პერტექნეტატის პრეკურსორს.
- Tc2O7 + 2 NaOH → 2 NaTcO2 + H2O
შავი ფერის ტექნეციუმის დიოქსიდი (TcO2) შეიძლება მივიღოთ ჰეპტოქსიდის ტექნეციუმით ან წყალბადით აღდგენით.
პერტექნიტ მჟავა (HTcO4) მიიღება Tc2O7-ის ურთიერტქმედებით წყალთან ან დამჟანგველ მჟავებთან, მაგალითად, აზოტმჟავასთან, გოგირდმჟავასთან, სამეფო წყალთან აზოტმჟავისა და ქლორწყალბადმჟავის ნარევთან. შედეგად მიიღება მუქი წითელი, ჰიგროსკოპული (წყალმშთანთქმელი) ნივთიერება, რომელიც წარმოადგენს მჟავას და ადვილად იძლევა პროტონებს.
დარჩენილი პერტექნატ იონი TcO4− წარმოადგენს ტეტრაედრს, რომლის ცენტრში არის ტექნეციუმის ატომი, ხოლო კუთხეებში კი ჟანგბადის ატომი. განსხვავებით პერმანგანატისაგან (MnO4−), იგი წარმოადგენს სუსტ დამჟანგველ აგენტს.
პერტექნატი ხშირად გამოიყენება წყალში ხსნადი Tc-ის იზოტოპების, როგორიცაა 99 მეტა Tc და აგრეთვე კატალიზატორის მისაღებად.
სულფიდები, სელენიდები, ტელურიდები[რედაქტირება | წყაროს რედაქტირება]
ტექნეციუმი წარმოქმნის მრავალ სულფიდს. TcS2 მიიღება ტექნეციუმის პირდაპირი ურთიერთქმედებით გოგირდტან, ხოლო Tc2S7 წარმოიქმნება პერტექნიკმჟავისაგან
2 HTcO4 + 7 H2S → Tc2S7 + 8 H2O
ამ რეაქციაში ტექნეციუმი არ აღდგება, როგორც ეს ხდება მანგანუმთან მსგავს რეაქციაში. გაცხელებით ტექნეციუმ ჰეპტასულფიდი იშლება დისულფიდად და ელემენტარულ გოგირდად.
Tc2S7 → 2 TcS2 + 3 S
ანალოგიური რეაქცია გვხვდება სელენთან და ტელურთან.
კლასტერები და ორგანული კომპლექსები[რედაქტირება | წყაროს რედაქტირება]



ცნობილია ტექნეციუმის რამდენიმე სახის დაჯგუფება Tc4, Tc6, Tc8 და Tc13. ყველაზე სტაბილურია Tc6 და Tc8 დაჯგუფებები, რომელთაც აქვთ პრიზმის ფორმა, სადაც ტექნეციუმის ატომების ვერტიკალური წყვილი დაკავშირებულია სამმაგი ბმით და პლანარული ატომები კი ერთმაგი ბმით. თითოეული Tc ატომი წარმოქმნის ექვს ბმას, ხოლო დარჩენილი სავალენტო ელექტრონები გაჯერებულია ერთი აქსიალური და ორი ხიდური ლიგანდის ჰალოგენატომებით, როგორიცაა ქლორი ან ბრომი.
ტექნეციუმი წარმოქმნის მრავალ ორგანულ კომპლექსს, რომლებიც კარგადაა შესწავლილი, რადგანაც მათ დიდი მნიშვნელობა აქვთ ბირთვულ მედიცინაში. ტექნეციუმის კარბონილი (Tc2(CO)10) წარმოადგენს თეთრ, მყარ ნაერთს. მის მოლეკულაში ტექნეციუმის ორი ატომი სუსტადაა დაკავშირებული ერთმანეთთან, ხოლო თითოეული ატომი გარშემოტყმულია ოქტაედრულად. ხუთი კარბონილის ლიგანდით. ტექნეციუმის ატომებს შორის ბმის სიგრძე შეადგენს 303 პიკომეტრს. ორი მეტალური ტექნეციუმის ატომებს მსგავს კარბონილებს წარმოქმნის მანგანუმი და რენიუმი.
ტექნეციუმის კომპლექსები ორგანული ლიგანდებით ჩვეულებრივ გამოიყენებიან ბირთვულ მედიცინაში. იგი შეიცავს უნიკალურ Tc-O ფუნქციურ ჯგუფს, რომელიც ორიენტირებულია მოლეკულის სიბრტყისა, სადაც შეიძლება ჟანგბადის ატომი ჩანაცვლდეს აზოტის ატომით.
იზოტოპები[რედაქტირება | წყაროს რედაქტირება]
ტექნეციუმის ზოგი იზოტოპის რადიოაქტიური თვისებები [3]:
| მასური რიცხვი | ნახევარდაშლის პერიოდი | დაშლის ტიპი |
|---|---|---|
| 92 | 4,3 წთ | β+, ელექტრონული მიტაცება (ბეტა დაშლა) |
| 93 | 43,5 წთ | ელექტრონული მიტაცება (18 %), იზომერული გადასვლა (82 %) |
| 93 | 2,7 სთ | ელექტრონული მიტაცება (85 %), β+ (15 %) |
| 94 | 52,5 წთ | ელექტრონული მიტაცება (21 %), იზომერული გადასვლა (24 %), β+ (55 %) |
| 94 | 4,9 სთ | β+ (7 %), ელექტრონული მიტაცება (93 %) |
| 95 | 60 დღეღამე | ელექტრონული მიტაცება, იზომერული გადასვლა (4 %), β+ |
| 95 | 20 სთ | ელექტრონული მიტაცება |
| 96 | 52 წთ | იზომერული გადასვლა |
| 96 | 4,3 დღე-ღამე | ელექტრონული მიტაცება |
| 97 | 90,5 დღეღამე | ელექტრონული მიტაცება |
| 97 | 2,6×106 წელი | ელექტრონული მიტაცება |
| 98 | 1,5×106 წელი | β− |
| 99 | 6,04 სთ | იზომერული გადასვლა |
| 99 | 2,12×106 წელი | β− |
| 100 | 15,8 წმ | β− |
| 101 | 14,3 წთ | β− |
| 102 | 4,5 წთ / 5 წმ | β− / γ/β− |
| 103 | 50 წმ | β− |
| 104 | 18 წთ | β− |
| 105 | 7,8 წთ | β− |
| 106 | 37 წმ | β− |
| 107 | 29 წმ | β− |
გამოყენება[რედაქტირება | წყაროს რედაქტირება]
ტექნეციუმი გამოიყენება მედიცინაში კუჭ-ნაწლავის კონტრასტული სკანირებისათვის.
პერტექნეტატებს (ტექნეციუმის მჟავის HTcO4 მარილი) აქვთ ანტოკოროზიული თვისებები, რადგანაც TcO4− იონი, MnO4− და ReO4− იონებთან განსხვავებით, წარმოადგენს ყველაზე ეფექტურ კოროზიის ინგიბიტორს რკინისათვის და ფოლადისათვის.
ბიოლოგიური როლი[რედაქტირება | წყაროს რედაქტირება]
ქიმიური თვალსაზრისით ტექნეციუმი და მისი ნაერთები ნაკლებად ტოქსიკურები არიან. ტექნეციუმის საშიშია მისი რადიოაქტიურობის გამო.
ტექნეციუმი ორგანიქმში მოხვედრისას ხვდება თითქმის ყველა ორგანოში, მაგრამ ძირითადად კუჭსა და ფარისებრ ჯირკვლებში. ორგანოების დაზიანებას იწვევს მისი β-გამოსხივება, რომლის დოზებია 0,1 რ/(სთ·მგ).
ტექნეციუმთან მუშაობისას გამოიყენება გამწოვი კარადები დამცავებით მისი β-გამოსხივებისაგან ან ჰერმეტული ბოქსები.
რესურსები ინტერნეტში[რედაქტირება | წყაროს რედაქტირება]
- ტექნეციუმი chemistry.ge-ზე
- ტექნეციუმი Webelements-ზე
- ტექნეციუმი ქიმიური ელემენტების პოპულარულ ბიბლიოთეკაში დაარქივებული 2009-03-03 საიტზე Wayback Machine.
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ დოლიძე ვ., ციციშვილი ვ., „ოთხენოვანი ქიმიური ლექსიკონი“, თბ., 2004, გვ. 219
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 9, თბ., 1985. — გვ. 702.
- ↑ List. დაარქივებულია ორიგინალიდან — 2013-08-16. ციტირების თარიღი: 2012-01-29.
| ქიმიურ ელემენტთა პერიოდული სისტემა | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| 8 | 119 | 120 | ⁂ | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 | ||||||||||
| ⁂ | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||




