წყალბადი

 | |||||||||||||||||||||||
| ზოგადი თვისებები | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | უსუნო, უფერული აირი | ||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(H) |
[1.00784, 1.00811][1] | ||||||||||||||||||||||
| წყალბადი პერიოდულ სისტემაში | |||||||||||||||||||||||
| |||||||||||||||||||||||
| ატომური ნომერი (Z) | 1 | ||||||||||||||||||||||
| ჯგუფი | 1 ჯგუფი (წყალბადი და ტუტე ლითონი) | ||||||||||||||||||||||
| პერიოდი | 1 პერიოდი | ||||||||||||||||||||||
| ბლოკი |
| ||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | 1s1 | ||||||||||||||||||||||
| ელექტრონი გარსზე | 1 | ||||||||||||||||||||||
ელემენტის ატომის სქემა | |||||||||||||||||||||||
| ფიზიკური თვისებები[2] | |||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | აირი | ||||||||||||||||||||||
| დნობის ტემპერატურა |
(H2) −259.16 °C (13.99 K, −434.49 °F) | ||||||||||||||||||||||
| დუღილის ტემპერატურა |
(H2) −252.879 °C (20.271 K, −423.182 °F) | ||||||||||||||||||||||
| სიმკვრივე (ნსპ) | 0.08988 გ/ლ | ||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 0.0763 გ/სმ3 | ||||||||||||||||||||||
| სიმკვრივე (დ.წ.) | 0.07099 გ/სმ3 | ||||||||||||||||||||||
| სამმაგი წერტილი | 13.8033 K, 7.041 კპა | ||||||||||||||||||||||
| კრიტიკული წერტილი | 32.938 K, 1.2858 მპა | ||||||||||||||||||||||
| დნობის კუთ. სითბო | (H2) 0.117 კჯ/მოლი | ||||||||||||||||||||||
| აორთქ. კუთ. სითბო | (H2) 0.904 კჯ/მოლი | ||||||||||||||||||||||
| მოლური თბოტევადობა | (H2) 28.836 ჯ/(მოლი·K) | ||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| |||||||||||||||||||||||
| ატომის თვისებები[2] | |||||||||||||||||||||||
| ჟანგვის ხარისხი | −1, +1 | ||||||||||||||||||||||
| ელექტროდული პოტენციალი |
| ||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 2.20 | ||||||||||||||||||||||
| იონიზაციის ენერგია |
| ||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 31±5 პმ | ||||||||||||||||||||||
| იონური რადიუსი (rion) |
54 (−1 e) პმ | ||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 120 პმ | ||||||||||||||||||||||
| მოლური მოცულობა | 14.1 სმ3/მოლი | ||||||||||||||||||||||
|
წყალბადის სპექტრალური ზოლები | |||||||||||||||||||||||
| სხვა თვისებები[2] | |||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | ||||||||||||||||||||||
| მესრის სტრუქტურა |
ჰექსაგონალური  | ||||||||||||||||||||||
| მესრის პერიოდი | 3.750 Å | ||||||||||||||||||||||
| ბგერის სიჩქარე | 1310 მ/წმ | ||||||||||||||||||||||
| თერმული გაფართოება | 0.1805 µმ/(მ·K) | ||||||||||||||||||||||
| ხვედრითი თბოტევადობა | 14.267 ჯ/(K·მოლ) | ||||||||||||||||||||||
| თბოგამტარობა | 0.1815 ვტ/(მ·K) | ||||||||||||||||||||||
| მაგნეტიზმი | დიამაგნეტიკი | ||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | −3.98×10−6 სმ3/მოლ | ||||||||||||||||||||||
| CAS ნომერი |
12385-13-6 (H2) 1333-74-0 | ||||||||||||||||||||||
| ისტორია | |||||||||||||||||||||||
| აღმომჩენია | ჰენრი კავენდიში (1766) | ||||||||||||||||||||||
| სახელი დაარქვა | ანტუან ლავუაზიე (1783) | ||||||||||||||||||||||
| წყალბადის მთავარი იზოტოპები | |||||||||||||||||||||||
| |||||||||||||||||||||||
| • | |||||||||||||||||||||||
წყალბადი[4][5] (ლათ. Hydrogenium — „წყლის წარმომქმნელი“ < ძვ. ბერძნ. ὕδωρ [hudôr] — „წყალი“ და γεννᾰν [gennen] — „წარმოქმნა“; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის პირველი ჯგუფის (მოძველებული კლასიფიკაციით — პირველი/მეშვიდე ჯგუფის მთავარი ქვეჯგუფის, Iა/VIIა), პირველი პერიოდის ქიმიური ელემენტი, ატომური ნომრით 1.[⇨]
წყალბადის სტანდარტული ატომური წონაა, დიაპაზონი — [1.00784, 1.00811].[⇨] ბუნებრივი წყალბადი შედგება ორი სტაბილური იზოტოპისაგან (პროტიუმი[6]; ≈99.98 %[3]) და (დეიტერიუმი[7]; ≈0.02%[3]). ხელოვნურად მიღებულია რადიოაქტიული იზოტოპი (ტრიტიუმი[8]; T1/2=12.33 წ[3]) და არამდგრადი ნუკლიდები, რომელთა მასური რიცხვი 4-დან 7-მდე მერყეობს.[⇨]
წყალბადის tდნ — (−259.16) °C, tდუღ — (−252.879) °C, სიმკვრივე (ნსპ) — 0.08988 გ/ლ. ჩვეულებრივ ტემპერატურაზე წყალბადი უსუნო, უფერული აირია.[⇨]
აღმოჩენის ისტორია
[რედაქტირება | წყაროს რედაქტირება]XVI-XVII საუკუნეებში ქიმიის როგორც მეცნიერების ჩამოყალიბების ხანაში აღმოაჩინეს, რომ ლითონებისა და მჟავების ურთიერთქმედებისას გამოიყოფოდა ადვილად აალებადი აირი. 1766 წელს ეს აირი გამოიკვლია ინგლისელმა მეცნიერმა ჰ. კავენდიშმა, რომელსაც „საწვავი ჰაერი“ უწოდა. მან შეამჩნია, რომ წვის შედეგად აირიდან მიიღებოდა წყალი, მაგრამ მეცნიერი ფლოგისტონის თეორიის მიმდევარი იყო, რამაც მას სწორი დასკვნების გამოტანაში ხელი შეუშალა და თვლიდა, რომ ეს აირი ფლოგისტონი იყო. 1783 წელს, სპეციალური გაზომეტრების გამოყენებით ა. ლავუაზიემ და ჟ. მენიემ ასინთეზეს წყალი, ხოლო შემდეგ კი მისი ანალიზისა და ცდების შედეგად მეცნიერებმა დადგინეს, რომ ჟანგბადი წყლის შემადგენლობაში შედის. 1787 წელს ლავუაზიე მივიდა იმ დასკვნამდე, რომ წყალბადი წარმოადგენდა ქიმიურ ელემენტს და მას „წყლის დამბადებელი“ („hydrogène“ < ძვ. ბერძნ. hydōr — „წყალი“ და gennaō — „ვბადებ“) უწოდა. წყლის შედგენილობის დადგენამ საბოლოოდ დაანგრია „ფლოგისტონის თეორია“, რამაც დიდი როლი ითამაშა ქიმიის განვითარებაში.
XVIII და XIX საუკუნეთა მიჯნაზე დადგინდა, რომ ქიმიურ ელემენტებს შორის, წყალბადის ატომს გააჩნია ყველაზე მცირე მასა, რის გამოც ეს სიდიდე ეტალონად იყო მიჩნეული.
იზოტოპები
[რედაქტირება | წყაროს რედაქტირება]ეს სტატია ან სექცია მანქანურადაა თარგმნილი და შეიცავს ენობრივ ხარვეზებს. |
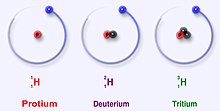
წყალბადის ატომს გააჩნია რამდენიმე იზოტოპი, რომლებიც იმდენად განსხვავდებიან მასით, რომ მათი ფიზიკური თვისებები (ნაწილობრივ ქიმიურიც) მნიშვნელოვნად განსხვავებულია ერთმანეთისგან, რაც განპირობებულია წყალბადის იზოტოპთა ატომურ მასათა დიდი სხვაობით.
- პროთიუმი (ლათ. Protium < ბერძ. protos — „პირველი“), მასური რიცხვი – 1, აღინიშნება სიმბოლოთი – H, ბირთვს ეწოდება – პროტონი და აღინიშნება ლათინური ასოთი – р.
- დეიტერიუმი (ლათ. Deuterium < ბერძ. deutero — „მეორე“), მასური რიცხვი – 2, აღინიშნება სიმბოლოთი – D, ბირთვს ეწოდება – დეიტრონი და აღინიშნება ლათინური ასოთი – d.
- ტრიტიუმი (ლათ. Tritum < ბერძ. tritos — „მესამე“), მასური რიცხვი – 3, აღინიშნება სიმბოლოთი – Т, ბირთვს ეწოდება – ტრიტონი და აღინიშნება ლათინური ასოთი – t.
ნეიტრალურ მდგომარეობაში წყალბადის ატომის რადიუსია — 0.024 ნმ. ატომის იონიზაციის ენერგიაა – 13.595 ევ. პოლინგის სკალის მიხედვით წყალბადის ელექტროუარყოფითობაა – 2.20. თავისუფალ მდგომარეობაში – უსუნო, უგემო და უფერო ადვილად აალებადი აირია. წყალბადი ყველაზე მსუბუქი და გავრცელებული ელემენტია სამყაროში.
პროთიუმი და დეიტერიუმი წარმოადგენენ სტაბილურ იზოტოპებს მასური რიცხვით 1 და 2. მათი შემცველობა ბუნებაში შესაბამისად შეადგენს 99,9885 ± 0,0070 % და 0,0115 ± 0,0070 %[9]. ეს შეფარდება შეიძლება უმნიშვნელოდ იცვლებოდეს წყალბადი მიღების წყაროსა და ხერხის მიხედვით.
წყალბადის იზოტოპი ტრიტიუმი არასტაბილურია. მისი ნახევარდაშლის პერიოდი შეადგენს 12.32[9] წელს. ტრიტიუმი ბუნებაში ძალიან მცირე რაოდენობითაა გავრცელებული.
ლიტერატურაში[9] ასევე მოყვანილია მონაცემები წყალბადის იზოტოპები მასური რიცხვით 4 — 7 და ნახევარდაშლის პერიოდით 10−22 — 10−23 წმ.
ბუნებრივი წყალბადი შედგება და (დეიტოწყალბადი) ატომებისაგან შეფარდებით 3200:1. სუფთა დეიტერიუმ წყალბადის შემცველობა კიდევ უფრო მცირეა. კონცენტრაციის შეფარდება და , მიახლოებით, 6400:1.
ქიმიური ელემენტების ყველა იზოტოპებს შორის წყალბადის იზოთოპების ქიმიური და ფიზიკური თვისებები ერთრმანეთისაგან ყველაზე უფრო ძლიერად განსხვავდებიან. ეს დაკავშირებულია ატომების წონის შედარებითი დიდი ცვლილებით[10].
| დნობის ტემპერატურა. K |
დუღილის ტემპერატურა. K |
სამმაგი წერტილი. K / კპა |
კრიტიკული წერტილი. K / კპა |
სიმკვრივე თხევადი / აირი. კგ/მ³ | |
|---|---|---|---|---|---|
| H2 | 13.96 | 20.39 | 13.96 / 7.3 | 32.98 / 1.31 | 70.811 / 1.316 |
| HD | 16.65 | 22.13 | 16.60 / 12.8 | 35.91 / 1.48 | 114.80 / 1.802 |
| HT | 22.92 | 17.63 / 17.7 | 37.13 / 1.57 | 158.62 / 2.310 | |
| D2 | 18.65 | 23.67 | 18.73 / 17.1 | 38.35 / 1.67 | 162.50 / 2.230 |
| DT | 24.38 | 19.71 / 19.4 | 39.42 / 1.77 | 211.54 / 2.694 | |
| T2 | 20.63 | 25.04 | 20.62 / 21.6 | 40.44 / 1.85 | 260.17 / 3.136 |
დეიტერიუმს და ტრიტიუმს ასევე აქვთ ორთო- და პარა- მოდიფიკაციები: p-D2, o-D2, p-T2, o-T2. ჰეტეროიზოტოპურ წყალბადს (HD, HT, DT) არ გააჩნიათ ორთო- და პარა- მოდიფიკაციები.
იზოტოპების თვისებები
[რედაქტირება | წყაროს რედაქტირება]წყალბადის მთავარი სტაბილური იზოტოპი ასევე ცნობილია, როგორც პროტიუმი. შედარებით ნაკლებად სტაბილური იზოტოპია ცნობილია, როგორც დეიტერიუმი (სიმბოლო D). ბუნებაში -ის დაბალმა კონცენტრაციამ განაპირობა მისი მხოლოდ 1931 წელს აღმოჩენა, როდესაც გარემოს ნიმუშებში წყალბადის იზოტოპის გამოყოფა მიმდინარეობდა დისტილაციის, ელექტროლიზისა და აორთქლების გზით. წყალბადის ატომური წონა ეფუძნება მას-სპექტრომეტრულ გაზომვებს 1938 წლიდან. 1961 წლის ანგარიშში CIAAW-მ რეკომენდაცია გაუწია წყალბადის Ar(H) = 1.007 97(1) დაახლოებით მნიშვნელობას, რომელიც ეფუძნებოდა -სა და -ის საშუალო მნიშვნელობას; თუმცა, იქვე აღინიშნა, რომ წყლის გარდა სხვა ნივთიერებებს შეიძლება ჰქონოდა ატომური წონის უფრო ფართო დიაპაზონი.
ამჟამად მიღებული საუკეთესო გაზომვა წყალბადის იზოტოპური შემადგენლობის ერთი ბუნებრივი წყაროდან განხორციელდა VSMOW-ზე (გავრცელებულ IAEA-სა და NIST-ის მიერ), საცნობარო მასალაზე დამტკიცებული CIAAW-ის მიერ, როგორც დელტას სკალის საფუძველი ფარდობითი იზოტოპური თანაფარდობის გაზომვებისთვის. ამ გაზომვის მიხედვით, VSMOW-ს აქვს სიდიდის ფრაქცია x (²H) = 0.000 155 74(5), რომელიც შეესაბამება A r (H) VSMOW = 1.007 981 75(5). ამ მნიშვნელობის გაურკვევლობა შეესაბამება δ(²H) გაურკვევლობა 0,3 ‰, რომელიც უდრის ან ოდნავ მცირეა H-ის ფარდობითი იზოტოპური თანაფარდობის გაზომვების ტიპურ გაურკვევლობაზე. ცნობილია, რომ წყალბადის იზოტოპური შემადგენლობის ვარიაციები ქიმიურ და ბუნებრივ ხმელეთის სისტემებში აღემატება +1000 ‰-ს, რაც ბევრად აღემატება გაურკვევლობას იზოტოპური თანაფარდობის გაზომვით.
წყლის წყაროებისთვის, გამოქვეყნებული მნიშვნელობების დიაპაზონი ვრცელდება −495 ‰-დან (Ar(H) = 1.007 9042), +129 ‰-მდე (Ar(H) = 1.008 0020). ზღვის წყალს აქვს შედარებით ერთგვაროვანი იზოტოპური შემადგენლობა და ატომური წონა VSMOW-თან ახლოს; ხოლო ნალექების, პოლარული ყინულის, ტბების, მდინარეებისა და მიწისქვეშა წყლების ატომური წონა ფართოდ მერყეობს. იგი ზოგადად მცირდება გრძედისა და სიმაღლეზე და იზრდება აორთქლებასთან ერთად. ყველაზე მაღალი მნიშვნელობა, რომელიც მოხსენებულია ბუნებრივი ხმელეთის წარმოშობის მასალისთვის არის +180 ‰ ატმოსფერული -ისთვის. ჭაბურღილიდან წყლის უჩვეულო ანთროპოგენურმა წარმოქმნამ გამოიტანა მნიშვნელობები +375 ‰ (Ar(H) = 1.008 0404). წყალბადის ნიმუშები დაბალი ატომური მასით, რომელთაგან ზოგიერთი სტანდარტული ატომური წონის გაურკვევლობის დიაპაზონს მიღმაა, მოხსენებულია ზოგიერთი ტიპის ბუნებრივი და ხელოვნური აირებიდან, აქედან გამომდინარე, ანოტაცია "g". ბუნებრივად წარმოქმნილი წყალბადის ნიმუში ყველაზე დაბალი ატომური მასით, = −836 ‰ და Ar(H) = 1.007 8507, არის გაზი, რომელიც შეგროვებულია ბუნებრივი აირის ჭაბურღილიდან კანზასში, აშშ. ეს ნიმუში და სხვა მსგავსი -გამოცლილი -სხვაგან მდიდარი ბუნებრივი აირები შეიძლება წარმოიქმნას წყლის ბუნებრივი ქიმიური შემცირებით ულტრამაფიკურ (--სილიკატური) ქანებთან დაბალი ტემპერატურის რეაქციების დროს. წყალბადის აირები, რომლებიც წარმოიქმნება ხელოვნურად ელექტროლიზით და როგორც ნავთობქიმიური დამუშავების ქვეპროდუქტები, ჩვეულებრივ მცირდება -ში. თუმცა ეს არ არის ბუნებრივი, ეს აირები ითვლება მნიშვნელოვანად, რადგან ისინი ჩვეულებრივ გამოიყენება ლაბორატორიებში. კომერციულ ავზ -ს აქვს δ(²H) −813 ‰ (Ar(H) = 1.007 8543).
რადიოაქტიური იზოტოპი , ასევე ცნობილია როგორც ტრიტიუმი (სიმბოლო T), იშლება უარყოფითი ბეტა-დაშლით -მდე, ნახევარდაშლის პერიოდით 12.3 წელი. ტრიტიუმი ბუნებრივად წარმოიქმნება ატმოსფეროში კოსმოსური სხივების ზემოქმედების შედეგად, როგორიცაა და ხელოვნურად ბირთვულ რეაქტორებში. ატმოსფეროში ძირითადად 1950-იან და 1960-იან წლებში დიდი რაოდენობით ტრიტიუმი მოხვდა, როგორც თერმობირთვული ბომბის ტესტების გვერდითი პროდუქტი. ტრიტიუმი რეაგირებს ატმოსფეროში და წარმოქმნის HTO-ს და სხვა ნაერთებს, რომლებიც გავრცელებულია სხვადასხვა კონცენტრაციით დედამიწის მახლობლად ზედაპირულ გარემოში. ტრიტიუმის კონცენტრაცია წყალბადის ბუნებრივ წყაროებში ძალიან დაბალია რამდენიმე რიგით, რათა იქონიოს ეფექტი წყალბადის ატომურ წონაზე.
| იზოტოპი | Z | N | ატომური მასა (მ.ა.ე.) |
ნახევარდაშლის პერიოდი | სპინი | % ბუნებაში | დაშლის ტიპი და ენერგია | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1.007 825 032 07(10) | სტაბილურია | 1⁄2+ | 99.9885(70)% | ||
| 2H | 1 | 1 | 2.014 101 777 8(4) | სტაბილურია | 1+ | 0.0115(70)% | ||
| 3H | 1 | 2 | 3.016 049 277 7(25) | 12.32(2) წელი | 1⁄2+ | β− | 18.591(1) კილო ელექტრო ვოლტი (კ.ე.ვ.) | |
| 4H | 1 | 3 | 4.027 81(11) | 1.39(10)×10−22 წმ | 2− | -n | 23.48(10) მეგა ელექტრო ვოლტი (მ.ე.ვ.) | |
| 5H | 1 | 4 | 5.035 31(11) | >9.1×10−22 წმ | (1⁄2+) | -nn | 21.51(11) მ.ე.ვ. | |
| 6H | 1 | 5 | 6.044 94(28) | 2.90(70)×10−22 წმ | 2− | −3n | 24.27(26) მ.ე.ვ. | |
| 7H | 1 | 6 | 7.052 75(108) | 2.3(6)×10−23 წმ | 1⁄2+ | -nn | 23.03(101) მ.ე.ვ. | |
მრგვალ ფრჩხილებში მოყვანილია მნიშვნელობის საშუალოკვადრატული გადახრა ბოლო განმუხტვის შესაბამისი რიცხვის ერთეულებში[9][11].
სტანდარტული ატომური წონა
[რედაქტირება | წყაროს რედაქტირება]
2009 წელს თეორიული და გამოყენებითი ქიმიის საერთაშორისო კავშირის კომისიამ შეცვალა წყალბადის სტანდარტული ატომური წონის Ar(H) რეკომენდირებული მნიშვნელობა, ატომური წონის დიაპაზონით [1.00784; 1.00811], რომელიც ეფუძნება დედამიწის ქერქის ნიმუშებში წყალბადის იზოტოპური სიმრავლის ცვალებადობას. წყალბადის სტანდარტული ატომური წონის ეს ცვლილება გამიზნულია იმის ხაზგასასმელად, რომ წყალბადის ატომური წონა ბუნებაში არ არის უცვლელი სიდიდე, არამედ დამოკიდებულია ნიმუშის წარმომავლობაზე. ატომური წონის ინტერვალის ქვედა ზღვარი შეესაბამება წყალბადს ბუნებრივ აირში, ხოლო ზედა ზღვარი — ბენზალდეჰიდის რეაგენტს, რომელიც წარმოიქმნება ტოლუენის კატალიზური დაჟანგვით. სტანდარტული ატომური წონის წინა მნიშვნელობას — Ar(H) = 1.00794(7) — რეკომენდაცია გაეწია 1981 წელს. აღნიშნული მნიშვნელობის ერთ-ერთი პრობლემა არის ის, რომ 1.00794 ატომური წონის ნიმუშის პოვნა საკმაოდ რთული იქნება. მაგალითად, წყალბადის ატომური წონა უმეტეს ჰიდროლოგიურ სისტემებში 1.00797-ზე მეტია[12].
წყალბადის ატომური მასის Ar(H)-ის ისტორიული მნიშვნელობებია:
- 1882 — 1.00;
- 1894 — 1.008;
- 1931 — 1,0078;
- 1938 — 1,0081;
- 1940 — 1.0080;
- 1961 — 1.00797;
- 1969 — 1.0080;
- 1971 — 1.0079;
- 1981 — 1.00794(7).
გავრცელება
[რედაქტირება | წყაროს რედაქტირება]სამყაროში
[რედაქტირება | წყაროს რედაქტირება]წყალბადი — ყველაზე გავრცელებული ელემენტია სამყაროში. მასზე მოდის ყველა ატომის მიახლოებით 92 % (8 %-ს შეადგენს ჰელიუმის ატომები, ხოლო ერთად აღებული დანარჩენი ელემენტების ატომების რაოდენობა შეადგენს მხოლოდ — 0,1 %-ზე ნაკლებს). ასე რომ წყალბადი - წარმოადგენს ვარსკვლავების და ვარსკვლავთშორისი გაზის ძირითად კომპონენტსა. ვარსკვლავური ტემპერატურების პირობებში (მაგალითად, მზის ზედაპირის ტემპერატურაა ~ 6000 °C) წყალბადი არსებობს პლაზმის სახით, ვარსკვლავთშორის სივრცეში ეს ელემენტი არსებობს ცალკე მოლეკულების, ატომებისა და იონების სახით და შეუძლია წარმოქმნას მოლეკულური ღრუბელი, რომლებიც მნიშვნელოვნად განსხვავდებიან ზომით, სიმკვრივითა და ტემპერატურით.
დედამიწის ქერქი და ცოცხალი ორგანიზმები
[რედაქტირება | წყაროს რედაქტირება]წყალბადის წონითი ხვედრი დედამიწის ქერქში შეადგენს 1 % -ს. ის მეათე ყველაზე გავრცელებული ელემენტია. მაგრამ მისი როლი ბუნებაში განისაზღვრება არა მისი წონით, არამედ ატომების რაოდენობით, რომლის წილი დანარჩენ ელემენტებს შორის შეადგენს 17 % (მეორე ადგილი ჟანგბადის შემდეგ, რომლის ატომების წილი შეადგენს ~ 52 %-ს). ამიტომაც წყალბადის მნიშვნელობა ქიმიურ პროცესებში, რომელიც დედამიწაზე მიმდინარეობს, თითქმის ისეთივე დიდია, როგორც ჟანგბადის.
ჟანგბადისაგან განსხვავებით, დედამიწაზე არსებული წყალბადი პრაქტიკულად ნაერთების სახითაა; მხოლოდ უმნიშვნელო რაოდენობით წყალბადია მარტივი ნივთიერების სახით (0,00005 %).
წყალბადი შედის თითქმის ყველა ორგანული ნივთიერების შემადგენლობაში და არის ყველა ცოცხალ უჯრედში. ცოცხალ უჯრედებში ატომების რაოდენობის მიხედვით წყალბადზე მოდის თითქმის 50 %.
მიღება
[რედაქტირება | წყაროს რედაქტირება]მარტივი ნივთიერებების სამრეწველო წარმოება დამოკიდებულია იმაზე, ბუნებაში თუ რა მდგომარეობაში არის ნორმალურ პირობებისას, ანუ რა შეიძლება გამოდგეს მის ნედლეულად, და რისგან მივიღოთ ის.
ჟანგბადი, რომელიც თავისუფალი მდგომარეობაშია, მიიღებენ ფიზიკური მეთოდით — თხევადი ჰაერიდან გამოყოფით. წყალბადი კი პრაქტიკულად მთლიანად ნაერთების სახითაა, ამიტომაც მის მისაღებად გამოიყენებენ ქიმიურ მეთოდებს. კერძოდ, შეიძლება გამოყენებული იქნას დაშლის რეაქციები. ერთ-ერთი ხერხია წყალბადის მიღება წყლის დაშლის რეაქცია ელექტრო დენით.
წყალბადის მიღების ძირითადი ხერხი მრეწველობაში არის — მეთანის რეაქცია წყალთან, რომელიც შედის ბუნებრივი გაზის შემადგენლობაში. ის მიმდინარეობს მაღალი ტემპერატურის პირობებში:
СН4 + 2Н2O = CO2↑ + 4Н2 −165 კჯ
ერთ-ერთი ლაბორატორიული მეთოდი წყალბადის მიღებისა, რომელიც ზოგჯერ გამოიყენება მრეწველობაში არის - წყლის დაშლა ელექტროდენით.
ჩვეულებრივ ლაბორატორიაში წყალბადს მიიღებენ თუთიისა და მარილმჟავას ურთიერთქმედებით.
მრეწველობაში
[რედაქტირება | წყაროს რედაქტირება]1.მარილების წყლის ხსნარების ელექტროლიზი
2.გახურებულ კოქსის ზევით წყლის ორთქლის გატარებით მიახლოებით 1000 °C ტემპერატურის პირობებში:
- კონვერსია წყლის ორთქლით:
- CH4 + H2O ⇄ CO + 3H2 (1000 °C)
- კატალიტიკური ჟანგვა ჟანგბადით:
- 2CH4 + O2 ⇄ 2CO + 4H2
4. ნახშირწყალბადების კრეკინგი და რიფორმინგი ნავთობის გადამუშავების პროცესში.
ლაბორატორიაში
[რედაქტირება | წყაროს რედაქტირება]1.გაზავებული მჟავეების ქმედებით ლითონებზე. ამ რეაქციის ჩასატარებლად ყველაზე ხშირად გამოიყენებენ 7766 82 თუთიას და გაზავებულ მარილმჟავას:
2.კალციუმის წყალთან ურთიერთქმედებით:
3.ჰიდრიდების ჰიდროლიზით:
4.ტუტეების ზემოქმედებით თუთიასა ან ალუმინზე:
5.ელექტროლიზის დახმარებით. ტუტეების ან მჟავეების წყლის ხსნარების ელექტროლიზისას კათოდზე მიმდინარეობს წყალბადის გამოყოფა, მაგალითად:
- 2H3O+ + 2e− → H2↑ + 2H2O
ფიზიკური თვისებები
[რედაქტირება | წყაროს რედაქტირება]

წყალბადი შეიძლება არსებობდეს ორ ფორმაში (მოდიფიკაციაში) — ორთო- და პარა- წყალბადები. ორთოწყალბადის მოლეკულაში o-H2 (დნ. ტემპ. −259,10 °C, დუღ. ტემპ. −252,56 °C) ბირთვული სპინები მიმართულია ერთნაირად (პარალელურად), ხოლო პარაწყალბადს p-H2 (დნ. ტემპ. −259,32 °C, დუღ. ტემპ. −252,89 °C) — ერთმანეთის საწინააღმდეგოდ (ანტიპარალელურად). o-H2 და p-H2 გაწონასწორებული ნარევს მოცემული ტემპერატურის დროს ეწოდება გაწონასწორებული წყალბადი e-H2.

წყალბადის მოდიფიკაციის დაყოფა შეიძლება ადსორბციით აქტიურ ნახშირზე თხევადი აზოტის ტემპერატურაზე. ძალიან დაბალ ტემპერატურებზე ორთო და პარაწყალბადებს შორის წონასწორობა თითქმის მთლიანად გადახრილია უკანასკნელის მხარეს. 80 К ტემპერატურისას ფორმების შეფარდება მიახლოებით 1:1 არის. დესორბირებული პარაწყალბადი გახურებისას გარდაიქმნება ორთოწყალბადად გაწონასწორებული ნარევის წარმოქმნით ოთახის ტემპერატურაზე (ორთო-პარა: 75:25). კატალიზატორის გარეშე გარდაქმნა მიმდინარეობს ნელა (ვარსკვლავებს შორის გარემოს პირობებში — დამახასიათებელი დროდადრო კოსმოლოგიურიც კი), რაც იძლევა ცალკეული მოდიფიკაციის შესწავლის საშუალებას.
წყალბადი — ყველაზე მჩატე აირია, ის ჰაერზე 14,5-ჯერ მჩატეა. ნათელია, რომ რაც უფრო ნაკლებია მოლეკულის წონა, მით უფრო მაღალია სიჩქარე ერთი და იგივე ტემპერატურაზე. წყალბადის როგორც ყველაზე მჩატე მოლეკულები მოძრაობენ ყველა სხვა მოლეკულებზე სწრაფად და ამის გამო მას შეუძლია უფრო სწრაფად გადასცეს სითბო ერთი სხეულიდან მეორეს. აქედან გამომდინარეობს ის, რომ წყალბადი ფლობს ყველაზე მაღალ თბოგამტარობას აიროვან ნივთიერებებს შორის. მისი თბოგამტარობა შვიდჯერ უფრო მაღალია ვიდრე ჰაერის თბოგამტარობა.
წყალბადის მოლეკულა ორ ატომიანია — Н2. ნორმალურ პირობებში სიმკვრივეა 0,08987 გ/ლ, დუღულის ტემპერატურაა −252,76 °C, წვის კუთრი სითბო 120.9×106 ჯ/კგ, ნაკლებად ხსნადია წყალში — 18,8 მლ/ლ.
წყალბადი კარგად იხსნება ბევრ ლითონში (Ni, Pt, Pd და სხვა), განსაკუთრებით პალადიუმში (850 მოცულობა 1 მოცულობა Pd-მზე). წყალბადის ხსნადობასთან ლითონებში დაკავშირებულია მისი უნარი დიფუნდირებისა; ნახშირბადიანი შენადნობების დიფუზიას (მაგალითად, ფოლადი) ზოგჯერ თან ახლავს შენადნობის დაშლა წყალბადისა და ნახშირბადის ურთიერთქმედების შედეგად (ეგრეთ წოდებული დეკარბონიზაცია). პრაქტიკულად არ იხსნება ვერცხლში.

თხევადი წყალბადი არსებობს მეტად ვიწრო ტემპერატურულ ინტერვალში −252,76-დან −259,2 °C-მდე. ეს არის უფერო სითხე, ძალიან მჩატე (სიმკვრივე −253 °C ტემპერატურისას არის 0,0708 გ/სმ³) და დენადი (სიბლანტე −253 °C ტემპერატურისას 13,8 სპუაზი). წყალბადის კრიტიკული პარამეტრები ძალიან დაბალია: ტემპერატურა −240,2 °C და წნევა 12,8 ატმ. ამით აიხსნება წყალბადის გათხევადობის სიძნელეები. თხევად მდგომარეობაში გაწონასწორებული წყალბადი შედგება 99,79 % პარა-Н2, 0,21 % ორთო-Н2 წყალბადისაგან.
მყარი წყალბადი, დნობით ტემპერატურა −259,2 °C, სიმკვრივე 0,0807 გ/სმ³ ( −262 °C ტემპერატურაზე) — თოვლისმაგვარი მასა, კრისტალები ჰექსოგონალური სინგონია, სივრცული ჯგუფი P6/mmc, უჯრედის პარამეტრი a=3,75 c=6,12. მაღალი წნევის დროს წყალბადი გადადის ლითონის მდგომარეობაში.
ქიმიური თვისებები
[რედაქტირება | წყაროს რედაქტირება]
წყალბადის მოლეკულები Н2 საკმაოდ მტკიცეა, და იმისათვის რომ, წყალბადი შევიდეს რეაქციაში საჭიროა დიდი ენერგიის დახარჯვა:
- Н2 = 2Н − 432 კჯ
ამიტომ ჩვეულებრივი ტემპერატურისას წყალბადი რეაგირებს მხოლოდ ძალიან აქტიურ ლითონებთან, მაგალითად კალციუმთან, კალციუმის ჰიდრიდის წარმოქმნით:
და ერთადერთ არალითონთან — ფტორთან, წარმოქმნის ფტორწყალბადს:
ლითონების უმრავლესობასთან და არალითონებთან წყალბადი რეაგირებს მომატებული ტემპერატურისას ან სხვა ზემოქმედებით, მაგალითად განათებისას:
მას შეუძლია «წაართვას» ჟანგბადი ზოგ ოქსიდს, მაალითად:
ჩაწერილი განტოლება ასახავს წყალბადის აღმდგენ თვისებებს.
ჰალოგენებთან ის წარმოქმნის ჰალოგენწყალბადებს:
მურთან ურთიერთქმედებს ძლიერი გახურებისას:
ურთიერთქმედება ტუტე და ტუტემიწა ლითონებთან
[რედაქტირება | წყაროს რედაქტირება]აქტიურ ლითონებთან ურთიერთქმედებისას წყალბადი წარმოქმნის ჰიდრიდებს:
ჰიდრიდები — მარილისმაგვარი, მყარი ნივთიერებებია, რომლებიც ადვილად ჰიდროლიზდება:
ლითონების ოქსიდებთან ურთიერთქმედება (როგორც წესი, d-ელემენტები)
[რედაქტირება | წყაროს რედაქტირება]ოქსიდები აღდგებიან ლითონებამდე:
ორგანული ნაერთების ჰიდრირება
[რედაქტირება | წყაროს რედაქტირება]მოლეკულური წყალბადი ფართოდ გამოიყენება ორგანულ სინთეზში ორგანული ნაერთების აღსადგენად. ამ პროცესებს უწოდებენ ჰიდრირების რეაქციები. ამ რეაქციებს ატარებენ კატალიზატორებთან ერთად მომატებული წნევისა და ტემპერატურის პირობებში. კატალიზატორი შეიძლება იყოს როგორც ჰომოგენური (მაგ. უილკინსონის კატალიზატორი), ისე ჰეტეროგენური (მაგ. რენეის ნიკელი, პალადიუმი ნახშირზე).
კერძოდ, გაუჯერებელი ნაერთების კატალიტიკური ჰიდრირებისას, როგორიცაა ალკენები და ალკინები, წარმოიქმნებიან გაჯერებული ნაერთები — ალკანები.
წყალბადის გეოქიმია
[რედაქტირება | წყაროს რედაქტირება]დედამიწაზე წყალბადის შემცველობა შემცირებულია მზესთან, პლანეტა-გიგანტებთან და პირველად მეტეორიტებთან შედარებით, რისგანაც გამომდინარეობს, რომ დედამიწა წარმოქმნისას იყო მნიშვნელოვნად დეგაზირებული და წყალბადმა სხვა მფრინავ ელემენტებთან ერთად დატოვა პლანეტა აკრეციის დროს ან მალევე მის შემდეგ.
თავისუფალი წყალბადი H2 შედარებით იშვიათად გვხვდება დედამიწის აირებში, მაგრამ წყლის სახით ის თამაშობს განსაკუთრებით მნიშვნელოვან როლს გეოქიმიურ პროცესებში.
მინერალების შემადგენლობაში წყალბადი შეიძლება შედიოდეს ამონიუმის იონის, ჰიდროქსილ-იონის და კრისტალური წყლის სახით.
ატმოსფეროში წყალბადი უწყვეტად წარმოიქმნება მზის გამოსხივების შედეგად წყლის დაშლით[13]. მცირე წონის გამო წყალბადის მოლეკულები ფლობენ დიფუზიური მოძრაობის დიდ სიჩქარეს (ის ახლოსაა მეორე კოსმოსურ სიჩქარესთან) და, ატმოსფეროს ზედა ფენებში მოხვედრისას, შეუძლიათ გაფრინდნენ კოსმოსურ სივრცეში.
წყალბადთან მუშაობის თავისებურებები
[რედაქტირება | წყაროს რედაქტირება]
წყალბადი ჰაერთან არევისას წარმოქმნის ფეთქებად ნარევს - ეგრეთ წოდებულ ფეთქებად გაზს (гремучий газ). ყველაზე ძლიერ ფეთქებადსაშიშია წყალბადი და ჟანგბადის მოცულობითი შეფარდებით 2:1, ან წყალბადი და ჰაერის მიახლოებით 2:5, რადგანაც ჟანგბადის შემცველობა ჰაერში მიახლოებით 21 %. ასევე წყალბადი ცეცხლსაშიშია. თხევადი წყალბადი კანზე მოხვედრისას იწვევს ძლიერ მოყინვას.
წყალბადის ფეთქებად საშიში კონცენტრაცია ჟანგბადთან წარმოიქმნება მოცულობის 4 %-დან 96 %-მდე. ჰაერთან ნარევებში მოცულობის 4 %-დან 75 (74) %-მდე.
გამოყენება
[რედაქტირება | წყაროს რედაქტირება]ატომარულ წყალბადს გამოიყენებენ ატომურ-წყალბადურ შედუღაბებაში.
- ამიაკის, მეთანოლის, საპონის და პლასტმასის წარმოებისათვის
- მარგარინის წარმოებაში თხევადი მცენარეული ზეთებისაგან.
- დარეგისტრირებულია როგორც საკვები დანამატი E949 (შესაფუთი აირი, კლასი «სხვები»).
წყალბადი მეტად მჩატეა და ჰაერში ყოველთვის მაღლა მიიწევს. ოდესღაც დირიჟაბლებს და საჰაერო ბურთებს (აეროსტატი) წყალბადით ავსებდნენ. მაგრამ XX საუკუნის 30-იან წლებში მოხდა რამდენიმე კატასტროფა, რომლის დროსაც დირიჟაბლები ფეთქებოდნენ და იწვებოდნენ. ახლა კი დირიჟაბლებს ავსებენ ჰელიუმით, მიუხედავად მისი მაღალი ღირებულებისა.
მზე ძირითადად შედგება წყალბადისაგან. მზის სითბო და სინათლე — ეს არის წყალბადის ბირთვების შეერთებისას გამონთავისუფლებული ბირთვული ენერგიის შედეგი.
წყალბადი გამოიყენება როგორც სარაკეტო საწვავი.
მიმდინარეობს კვლევები წყალბადის როგორც მსუბუქი და სატვირთო ავტომანქანების საწვავად გამოყენებისათვის. წყალბადის ძრავები არ აჭუჭყიანებენ გარემოს და გამოყოფენ მხოლოდ წყლის ორთქლს.
წყალბად-ჟანგბადურ საწავავ ელემენტებში გამოიყენება წყალბადი ქიმიური რეაქციის ენერგიის გარდაქმნისათვის ელექტრულ ენერგიად.
საწვავად გამოყენებული ნივთიერებების უმნიშვნელოვანეს მახასიათებელს, წარმოადგენს წვის სითბო. საერთო ქიმიის კურსიდან ცნობილია, რომ წყალბადსა და ჟანგბადს შორის რეაქცია მიმდინარეობს სითბოს გამოყოფით. თუ ავიღებთ 1 მოლ H2 (2გ) და 0,5 მოლ O2 (16 გ) სტანდარტულ პირობებში და აღვძრავთ რეაქციას, მაშინ განტოლების მიხედვით
- 2Н2 + О2= 2Н2О
რეაქციის დამთავრების შემდეგ წარმოიქმნება 1 მოლი H2O (18 გრ) 285,8 კჯ/მოლი ეერგიის გამოყოფით (შედარებისათვის: აცეტილენის წვის სითბო არის 1300 კჯ/მოლი, პროპანის — 2200 კჯ/მოლი). 1 მ³ წყალბადი იწონის 89,8 გრ (44,9 მოლს). ამიტომაც 1 მ³ წყალბადზე დახარჯული იქნება 12 832,4 კჯ ენერგია იმის გათვალისწინებით, რომ 1 კვტ·სთ = 3600 კჯ, მივიღებთ 3,56 კვტ·სთ ელექტროენერგიას.
თუ ვიცით 1 კვტ·სთ ელ. ენერგიის ტარიფი და აირის 1 მ³-ის ღირებულება, შეიძლება გავაკეთოთ დასკვნა წყალბადის საწვავზე გადასვლის მიზანშეწონილობაზე.
მაგრამ არ უნდა დავივიწყოთ ის, რომ წყალბადის წვისას ჩვენ ვღებულობთ სუფთა წყალს, იმას რისგანაც მივიღეთ ის. ანუ გვაქვს აღმდგენი რესურსი, რომლის გამოყენება არ ვნებს ბუნებას, ბენზინთან და საწვავ აირითან განსხვავებით, რომლებიც წარმოადგენენ ენერგიის პირველად წყაროს
საინტერესო ფაქტები
[რედაქტირება | წყაროს რედაქტირება]- წყალბადი - ყველაზე გავრცელებული ნივთიერებაა სამყაროში (მიახლოებით ყველა ატომების 90 %)[14].
- წყალბადი - ყველაზე მჩატე აირია. 1 ლიტრი წყალბადის წონა აიროვან მდგომარეობაში შეადგენს მხოლოდ 0,08988 გრამს[14].
- წყალბადის ჰორვატიული სახელია — Vodik, ხმარებაში შემოიღო ფილოლოგმა ბოგოსლავ შჩულეკმა.
იხილეთ აგრეთვე
[რედაქტირება | წყაროს რედაქტირება]- ანტიწყალბადი
- თხევადი წყალბადი
- წყალბადის ბომბი
- წყალბადის ელექტროდი
- წყალბადის ზეჟანგი
- წყალბადის მაჩვენებელი
- წყალბადის მოლეკულა
- წყალბადური ბმა
ლიტერატურა
[რედაქტირება | წყაროს რედაქტირება]- Реми Г., Курс неорганической химии, пер. с нем., т. 1, Москва, 1963
- ქიმიის დასაწყისი. თანამედროვე კურსები უმაღლეს სასწ-ში შემსვლელთათვის: სასწავლო სახელმძღ. უმაღლ. სასწ. /ნ. ე. კუზმენკო, ვ. ვ. ერემინი, ვ. ა. პოპკოვი. — მ.: გამომცემლ. „ეკზამენი“, 2005.
რესურსები ინტერნეტში
[რედაქტირება | წყაროს რედაქტირება]სქოლიო
[რედაქტირება | წყაროს რედაქტირება]- ↑ "Standard Atomic Weights: Hydrogen". CIAAW. 2009
- ↑ 2.0 2.1 2.2 webelements.com — "Hydrogen: the essentials"
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 webelements.com — "Hydrogen: isotope data"
- ↑ დოლიძე ვ., ციციშვილი ვ., „ოთხენოვანი ქიმიური ლექსიკონი“, თბ., 2004, გვ. 41
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 11, თბ., 1987. — გვ. 353.
- ↑ პროტიუმი — უცხო სიტყვათა ლექსიკონი
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 3, თბ., 1978. — გვ. 441.
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 10, თბ., 1986. — გვ. 54.
- ↑ 9.0 9.1 9.2 9.3 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). „The NUBASE evaluation of nuclear and decay properties“ (PDF). Nuclear Physics A. 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Züttel A.,Borgschulte A.,Schlapbach L. Hydrogen as a Future Energy Carrier.- Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0
- ↑ G. Audi, A.H. Wapstra, and C. Thibault (2003). „The AME2003 atomic mass evaluation (II). Tables, graphs, and references.“. Nuclear Physics A. 729: 337–676. doi:10.1016/j.nuclphysa.2003.11.003.
|title=-ში არის გარე ბმული (დახმარება)CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link) - ↑ Atomic weights of the elements 2009 (IUPAC Technical Report), 2010, გვ. 373-374
- ↑ ა.მ. პრავილოვი ფოტოპროცესი მოლეკულურ აირებში. მ.: ენერგოატომიზდატი, 1992.
- ↑ 14.0 14.1 გინესის რეკორდების წიგნი ქიმიური ელემენტებისათვის. დაარქივებულია ორიგინალიდან — 2012-01-05. ციტირების თარიღი: 2011-05-11.
| პორტალი „ქიმია“ | |
| წყალბადი ვიქსიკონში | |
| წყალბადი ვიკისაწყობში |
| ქიმიურ ელემენტთა პერიოდული სისტემა | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| 8 | 119 | 120 | ⁂ | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 | ||||||||||
| ⁂ | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||

















