ქიმიური ელემენტი
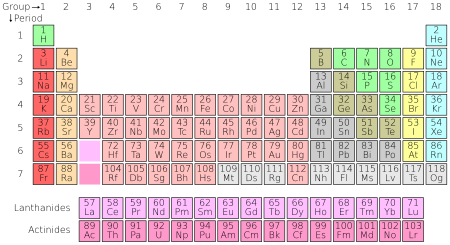
ქიმიური ელემენტი, ელემენტი — ერთი და იმავე ატომური ნომრის (ბირთვის მუხტის) მქონე იმ ატომთა ერთობლიობა, რომელთაც შეიძლება განსხვავებული ატომური მასა ჰქონდეთ. თითოეულ ქიმიურ ელემენტს აქვს საკუთარი ლათინური სახელი და ქიმიური სიმბოლო, რომელიც რეგულირდება IUPAC-ით და წარმოდგენილია ქიმიურ ელემენტთა პერიოდულ სისტემაში.
ეს ტერმინი აღნიშნავს აგრეთვე სუფთა ნივთიერებას, რომელიც შედგება ბირთვში ერთი და იმავე რაოდენობის პროტონების მქონე ატომებისაგან. ქიმიური რეაქციების დროს არ ხდება ქიმიური ელემენტების გარდაქმნა. ქიმიური ელემენტების გარდაქმნა შესაძლებელია მხოლოდ ბირთვული რეაქციების გზით. ქიმიური ელემენტის ეს თანამედროვე განსაზღვრება შემოიტანა რობერტ ბოილმა 1661 წელს და იგი უპირისპირდება პლატონისეულ ოთხი ელემენტის თეორიას.
ქიმიური რეაქციების დროს იცვლება ატომების გარეელექტრონთა შორის კავშირები, ხოლო ბირთვული რეაქციების დროს კი ხდება ატომის ბირთვის შემადგენელი ნუკლონების გარდაქმნა.
დღეისათვის ცნობილია 117 ელემენტი (1–დან 118–ის ჩათვლით გარდა 117–ესი), მათგან 94 გვხვდება ბუნებრივი სახით დედამიწაზე.
ჩვეულებრივ, ქიმიურ ელემენტებს განადასებენ მენდელეევის მიერ გამოგონებულ მენდელეევის ელემენტთა პერიოდულობის ცხრილში.
ქიმიურ ელემენტთა სახელები და სიმბოლოები[რედაქტირება | წყაროს რედაქტირება]
ქიმიურ ელემენტთა სახელები[რედაქტირება | წყაროს რედაქტირება]
ქიმიურ ელემენტთა სახელებს სხვადასხვა ენაში სხვადასხვა წარმოშობა აქვთ. ძველთაგანვე ცნობილი ელემენტების სახელები ქართულ ენაში (მაგ. ვერცხლი, რკინა, ტყვია...) , როგორც წესი ენის უძველეს ფენას მიეკუთვნება და მათი ეტიმოლოგიის დადგენა საკმაოდ შრომატევადია; ამ ელემენტების სახელებს მოპოვებათ კანონზომიერი შესატყვისები სხვა ქართველურ ენებშიც.
ზოგიერთი ელემენტის სახელი, მიუხედავად იმისა, რომ ქართველი ხალხი მათ უხსოვარი დროიდან იყენებს, ზოგიერთი ენათმეცნიერის მოსაზრებით უძველეს ნასესხობას წარმოადგენს, ასეთებია: კალა, სპილენძი, ოქრო...
ელემენტების ქართული სახელების შემუშავება–დამკვიდრებაში ფასდაუდებელი ღვაწლი მიუძღვით მეოცე საუკუნის დასაწყისის ქართველ მეცნიერთ, რომელთაც შეთხზეს ისეთი ელემენტების სახელები, როგორიცაა წყალბადი, ნახშირბადი, ჟანგბადი...
დანარჩენი ელემენტების სახელები ნასესხებია ლათინურიდან. ლათინური სახელების წარმოშობა მარავალფეროვანია და იგი უკავშირდება:
- მითოლოგიას: ტანტალი, თორიუმი, ნიობიუმი..
- ფერებს: ქრომი, რუბიდიუმი, ქლორი..
- გეოგრაფიას: პოლონიუმი, გერმანიუმი, ფრანციუმი, ევროპიუმი...
- აღმომჩენის ან გამოჩენილი პიროვნების სახელს: კიურიუმი, ფერმიუმი, ბორიუმი...
ქიმიურ ელემენტთა სიმბოლოები[რედაქტირება | წყაროს რედაქტირება]
ქიმიურ ელემენტთა სიმბოლოებად გამოიყენება ელემენტთა ლათინური სახელების აბრევიატურა. ქიმიური სიბოლო შედგება დიდი სათავო ლათინური ასოსაგან (ეს ასო ელემენტის ლათინური სახელის პირველი ასოა, მაგ. C - Carbon), რომელსაც შესაძლოა მოსდევდეს ლათინური პატარა ასო (მეორე ასოც ელემენტის ლათინურ სახელს უკავშირდება, მაგ. Na- Natrium, Hg- Hydrargyrum). ქიმიური სიმბოლოების ასეთი სისტემა 1814 წელს შემოგვთავაზა შვედმა ქიმიკოსმა ჯ. ბერცელიუსმა. ელემენტების დროებითი სიმბოლოები, რომლებიც გამოიყენება მათი მუდმივი სახელებისა და სიმბოლოების ოფიციალურ დამტკიცებამდე, შედგება სამი ლათინური ასოსგან, რაც ნიშნავს სამი ციფრის ლათინურ სახელებს მათი ატომური რიცხვის ათობითი აღნიშვნით (მაგალითად, ununoctium - 118-ე ელემენტს - ჰქონდა დროებითი აღნიშვნა. Uuo). ასევე გამოიყენება ზემოთ აღწერილი უმაღლესი რიგის ჰომოლოგების აღნიშვნის სისტემა (Eka-Rn, Eka-Pb და ა.შ.).
ელემენტის სიმბოლოს გვერდით მცირე რიცხვები მიუთითებს: ზედა მარცხნივ - ატომური მასა, ქვედა მარცხნივ - ატომური რიცხვი, ზედა მარჯვნივ - იონის მუხტი, ქვედა მარჯვნივ - ატომების რაოდენობა მოლეკულაში:
| ატომური მასა | იონის მუხტი | |
| ელემენტის სიმბოლო | ||
|---|---|---|
| რიგითი ნომერი | მოლეკულაში ატომთა რაოდენობა |
მაგალითები:
- — ნახშირბადის ატომი 6-ის ტოლი ბირთვის მუხტით და ატომური მასით — 12.
- — ერთმანეთისაგან დამოუკიდებელი ნახშირბადის ატომის კოეფიციენტი
პერიოდულ ცხრილში ქიმიური ელემენტის ბარათი როგორც წესი მოიცავს შემდეგ მაჩვენებლებს:
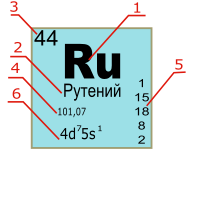
- ქიმიური ელემენტის აღნიშვნა;
- სახელწოდება;
- ქიმიური ელემენტის რიგითი ნომერი, რომელიც ტოლია ატომბირთვში პროტონების რაოდენობისა.
- ატომური მასა: მდგრადი იზოტოპების საშუალო მნიშვნელობა (რადიოაქტიული ელემენტებისათვის).
- ელექტრონების განაწილება ენერგეტიკული დონეების მიხედვით;
- ელექტრონული კონფიგურაცია.
იზოტოპია და იზოტოპები[რედაქტირება | წყაროს რედაქტირება]
როგორც ცნობილია, ატომის ბირთვი შედგება არა მხოლოდ პროტონებისაგან არამედ ნეიტრონებისაგანაც. არსებობს ისეთი ატომები, რომელთა ბირთვიც პროტონების ტოლ რაოდენობას შეიცავს, მაგრამ არ ემთხვევა ნეიტრონების რაოდენობა. ამ მოვლენას იზოტოპია ეწოდება, ხოლო ატომებს რომლებიც ერთმანეთისაგან ბირთვში ნეიტრონების რაოდენობით განსხვავდებიან იზოტოპები ეწოდებათ. იზოტოპების მაგალითია პროთიუმი (წყალბადის ბირთვი რომელიც შეიცავს ერთ პროტონს), დეითერიუმი(წყალბადის ბირთვი რომელიც შეიცავს 1 პროტონსა და ერთ ნეიტრონს) და ტრითიუმი (წყალბადის ბირთვი რომელიც შეიცავს ერთ პროტონსა და ორ ნეიტრონს).
იხილეთ აგრეთვე[რედაქტირება | წყაროს რედაქტირება]
ლიტერატურა[რედაქტირება | წყაროს რედაქტირება]
- ქართული საბჭოთა ენციკლოპედია, ტ. 10, თბ., 1986. — გვ. 530.
| |||||||||||||||||





