ბრომი
| ბრომი |
| 35Br |
| 79.904 |
| 3d10 4s2 4p5 |
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ზოგადი თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | წითელ-მოყავისფრო | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(Br) |
79.904 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბრომი პერიოდულ სისტემაში | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 35 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჯგუფი | 17 ჯგუფი (ჰალოგენები) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პერიოდი | 4 პერიოდი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბლოკი |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Ar] 3d10 4s2 4p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ელემენტის ატომის სქემა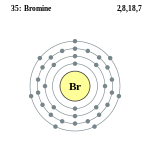 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | სითხე | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის ტემპერატურა |
842 °C (1115 K, 1548 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დუღილის ტემპერატურა |
1484 °C (1757 K, 2703 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 1,55 გ/სმ3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 1,378 გ/სმ3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 8,54 კჯ/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 154,7 კჯ/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 25,929 ჯ/(მოლი·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | 1, +2 (a strongly basic oxide) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი |
-2,76 ვ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 1,00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 197 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 176±10 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იონური რადიუსი (rion) |
(+2e) 99 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 231 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური მოცულობა | 29,9 სმ3/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ბრომის სპექტრალური ზოლები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სხვა თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა |
ორთორომბული  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის პერიოდი | 5,580 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 3810 მ/წმ (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თერმული გაფართოება | 22,3 µმ/(მ·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ხვედრითი თბოტევადობა | 25,9 ჯ/(K·მოლ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თბოგამტარობა | 201 ვტ/(მ·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნეტიზმი | დიამაგნეტიკი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | +40,0·10−6 სმ3/მოლ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იუნგას მოდული | 20 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| წანაცვლების მოდული | 7,4 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დრეკადობის მოდული | 17 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პუასონის კოეფიციენტი | 0,31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოოსის მეთოდი | 1,75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 170–416 მპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS ნომერი | 7440-70-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ისტორია | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აღმომჩენია | ჰამფრი დეივი (1808) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პირველი მიმღებია | ჰამფრი დეივი (1808) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბრომის მთავარი იზოტოპები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ბრომი[1][2] (ლათ. Bromum < ძვ. ბერძნ. βρῶμος — „მყრალი“; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეოთხე პერიოდის, მეჩვიდმეტე ჯგუფის (ძველი კლასიფიკაციით — მეშვიდე ჯგუფის მთავარი ქვეჯგუფის, VIIა) ქიმიური ელემენტი. მისი ატომური ნომერია 35, ატომური მასა — 79.904, tდნ — (−7.2) °C, tდუღ — 58.8 °C, სიმკვრივე — 3.1028 გ/სმ3. ქიმიურად აქტიური არალითონია, მიეკუთვნება ჰალოგენების ჯგუფს. მძიმე სითხეა, მოწითალო-მოყავისფრო ფერის, ძლიერი არასასიამოვნო სუნით. ბრომის მოლეკულა ორ ატომიანია (ქიმიური ფორმულაა Br2).
ისტორია[რედაქტირება | წყაროს რედაქტირება]
ბრომი აღმოჩენილი იქნა 1826 წელს მონპელიეს კოლეჯის ახალგაზრდა მასწავლებლის ანტუან ჟერომ ბალარის მიერ. ბალარი აღმოჩენამ მსოფლიოში ცნობილი გახადა. ერთი პოპულარული წიგნიდან მეორეში გადადის განცხადებები იმის შესახებ რომ, ნაწყენი რომ ვიღაც უცნობმა ბალარმა დაასწრო ცნობილ იუსტუს ლიბიხს ბრომის აღმოჩენა, თითქოს ლიბიხმა განაცხადა რომ ეს ბრომმა აღმოაჩინა ბალარი და არა ბალარმა ბრომიო. მაგრამ ეს არასწორია, უფრო სწორედ, მთლად სიმართლე არაა. ეს ფრაზა ეკუთვნოდა შარლ ფრედერიკ ჟერარს რომელსაც უნდოდა რომ სორბორნის ქიმიის კათედრა ოგუსტ ლორანს დაეკავებინა და არა პროფესორად ახლად არჩეულ ა. ბალარს.
სახელწოდების წარმომავლობა[რედაქტირება | წყაროს რედაქტირება]
ელემენტის სახელწოდება მოდის ძვ. ბერძნ. βρῶμος — სიტყვა სიმყრალედან.
არსებობა ბუნებაში[რედაქტირება | წყაროს რედაქტირება]
ბრომის კლარკია 1,6 გ/ტ. ბრომი ფართოდაა გავრცელებული ბუნებაში და გაბნეული სახით ის ყველგან გვხვდება. ბრომის თითქმის ყველა ნაერთი იხსნება წყალში და ამიტომაც ადვილად გამოირეცხება ქანებიდან. როგორც მინარევი ის ძალიან ბევრ მინერალშია. მაგრამ არსებობს მხოლოდ რამდენიმე წყალში უხსნადი მინერალი — ვერცხლის და სპილენძის ჰალოგენიდები. მათ შორის ყველაზე ცნობილია — ბრომარგირიტი AgBr. სხვა მინერალები — იოდობრომიტი Ag(Br, Cl, I), ემბოლიტი Ag(Cl, Br). ბრომის საკუთარი მინერალები ცოტაა იმიტომ რომ, მისი იონური რადიუსი ძალიან დიდია და ბრომის იონი საიმედოდ ვერ მაგრდება სხვა ელემენტების კრისტალურ მესერში, საშუალო ზომის კათიონებთან ერთად. ბრომის დაგროვებაში ძირითად ლორს თამაშობს ოკეანის წყლების აორთქლების პროცესი, რის შედეგადაც ის გროვდება როგორც თხევად, ისე მყარ ფაზაში. ბრომი მთის ქანებში ძირითადად იმყოფება იონების სახით, რომლებიც მიგრირებენ მიწისქვეშა წყლებთან ერთად. მიწის ბრომის ნაწილი დაკავშირებულია მცენარის ორგანიზმებში რთულ და უმეტესწილად უხსნად ორგანულ ნაერთებში. ზოგიერთი მცენარე აქტიურად აგროვებს ბრომს. ეს უპირველეს ყოვლისა არის პარკოსანი მცენარეები — ბარდა, ლობიო, ოსპი, ასევე ზღვის წყალმცენარეები. ზღვაში კონცენტრირებულია ბრომის დიდი ნაწილი. არის ის ასევე მარილიან ტბებში, და მიწისქვეშა წყალშემცველ პლასტებში, რომელიც თანხლებს საწვავ წიაღისეულ საბადოებს, ასევე კალიუმის მარილებს და ქვის მარილს. ბრომი არის ატმოსფეროშიც, ამასთან ამ ელემენტის შემცველობა ზღვისპირა რაიონების ჰაერში ყოველთვის მეტია, ვიდრე მკვეთრად კონტინენტალურ კლიმატში.
ბრომის წარმოებისათვის პირველად ნედლეულად გამოიყენებენ:
- ზღვის წყალს (65 მგ/ლ[3])
- მარილიანი ტბის წყალს
- კალიუმიან წარმოებებს
- ნავთობისა და აირის საბადოების მიწისქვეშა წყლებს
მიღება[რედაქტირება | წყაროს რედაქტირება]

ბრომს იღებენ ქიმიური გზით მარილწყლებიდან Br−:
ფიზიკური თვისებები[რედაქტირება | წყაროს რედაქტირება]
ჩვეულებრივ პირობებში ბრომი — მოწითალო-მოყავისფრო სითხეა მკვეთრი არასასიამოვნო სუნით, საწამლავია, კანთან შეხებისას წარმოიქმნება კანის დამწვრობა. ბრომი — ერთ-ერთია ორ მარტივ ნივთიერებას შორის, ვერცხლისწყალთან ერთად, რომელიც ოთახის ტემპერატურაზე თხევად მდგომარეობაშია. სიმკვრივე 0 °C არის — 3,19 გრ/სმ³. ბრომის დნობის ტემპერატურა (გამაგრება) −7,2 °C, დუღილის 58,8 °C, დუღილისას ბრომი სითხიდან გადაიქცევა მოყავისფრო ორთქლად, ჩასუნთქვისას აღიზიანებს სასუნთქ ორგანოებს. სტანდარტული ელექტროდული პოტენციალი Br2/Br− წყლის ხსნარში ტოლია +1,065 ვ.
ჩვეულებრივი ბრომი შედგება იზოტოპისაგან 79Br (50,56 %) და 81Br (49,44 %). ხელოვნურად მიღებულია რადიოაქტიური იზოტოპები.
ქიმიური თვისებები[რედაქტირება | წყაროს რედაქტირება]
| ბრომის ჟანგვის ხარისხი | |
|---|---|
| −1 | HBr |
| 0 | Br2 |
| +1 | BrCl |
| +3 | BrF3 |
| +5 | BrF5 |
| +5 | BrO3- |
| +7 | BrO4- |
თავისუფალი ბრომი ორ ატომიანი მოლეკულის სახით არსებობს Br2. მოლეკულის ატომებად დისოციაცია შეიმჩნევა 800 °C ტემპერატურის დროს და ჩქარა იზრდება ტემპერატურის შემდგომი ზრდისას. მოლეკულის დიამეტრი Br2 ტოლია 0,323 ნმ, ბირთვებს შორისი მანძილი ამ მოლეკულაში არის — 0,228 ნმ.
ბრომი ცოტათი, მაგრამ მაინც სხვა ჰალოგენებზე უფრო უკეთ იხსნება წყალში (3,58 გ - 100 გ წყალში, 20 °C-ზე), ხსნარს უწოდებენ ბრომიან წყალს. ბრომიან წყალში მიმდინარეობს ბრომწყალბადმჟავის და არამდგრადი ქვებრომოვანი მჟავის (HBrO) წარმოქმნის რეაქცია:
ორგანული გამხსნელების უმეტესობაში ბრომი ერევა ყველანაირ ურთიერთობაში, ამასთან ხშირად ხდება ორგანული გამხსნელის მოლეკულების ბრომირება.
ბრომს თავისი ქიმიური აქტივობით ქლორსა და იოდს შორის უჭირავს ადგილი. ბრომის და იოდიდების ხსნარების რეაქციისას გამოიყოფა თავისუფალი იოდი:
ხოლო, ქლორისა და ბრომიდების ხსნარების რეაქციისას პირუკუ, გამოიყოფა თავისუფალი ბრომი:
ბრომისა და გოგირდის რეაქციისას წარმოიქმნება S2Br2, ბრომის ფოსფორთან რეაქციისას — PBr3 და PBr5. ბრომი ასევე რეაგირებს არალითონებთან - სელენთან და ტელურთან.
ბრომის რეაქცია წყალბადთან მიმდინარეობს გახურებით და წარმოიქმნება ბრომწყალბადი HBr. HBr-ის წყლის ხსნარი წარმოადგენს — ბრომწყალბადმჟავას, თავისი ძალით ახლოსაა მარილმჟავასთან (HCl). ბრომწყალბადმჟავის მარილებია — ბრომიდები (NaBr, MgBr2, AlBr3 და სხ.). ხარისხობრივი რეაქცია ხსნარებში ბრომიდ-იონების არსებობაზე — Ag+ იონებთან ვერცხლის ბრომიდის AgBr ღია-მოყვითალო, წყალში პრაქტიკულად უხსნადი ნალექის შექმნა.
ჟანგბადთან და აზოტთან ბრომი უშუალოდ არ რეაგირებს. ბრომი სხვა დანარჩენ ჰალოგენებთან წარმოქმნის დიდი რაოდენობის სხვადასხვა ნაერთებს. მაგალითად, ფთორთან ბრომი ცარმოქმნის არამდგრად BrF3 და BrF5, იოდთან — IBr. ბევრ ლითონებთან ურთიერთქმედებით ბრომი წარმოქმნის ბრომიდებს, მაგალითად, AlBr3, CuBr2, MgBr2 და სხ. ბრომის ზემოქმედებისაგან მდგრადებია ტანტალი და პლატინა, უფრო ნაკლებად - ვერცხლი, ტიტანი და ტყვია.
ბრომი - ძლიერი მჟანგავია, ის ჟანგავს სულფიტ-იონს სულფატამდე, ნიტრიტ-იონს — ნიტრატამდე და ა.შ.
ორმაგკავშირებიან ორგანულ ნაერთებთან ურთიერთქმედებისას, ბრომი უერთდება მათ და იძლევა დიბრომწარმოებულებს:
C2H4 + Br2 → C2H4Br2.
ბრომი უერთდება ორგანულ მოლეკულებსაც, რომლის შემადგენლობაში სამმაგი კავშირებია. ბრომიანი წყლის გაუფერულება მასში აირის გატარებისას ან მასში სითხის დამატებისას მეტყველებს იმაზე, რომ აირში ან სითხეში არის უსაზღვრო ნაერთი.
კატალიზატორთან ერთად გახურებისას ბრომი რეაგირებს ბენზოლთან ბრომბენზოლის წარმოქმნით C6H5Br (ჩანაცვლების რეაქცია).
ბრომის ურთიერთქმედებით ტუტეების ხსნარებთან და ნატრიუმის ან კალიუმის კარბონატის ხსნარებთან წარმოიქმნება შესაბამისად ბრომიდები და ბრომატები, მაგალითად:
3Br2 + 3Na2CO3 → 5NaBr + NaBrO3+ 3CO2↑.
ბრომშემცველი მჟავეები[რედაქტირება | წყაროს რედაქტირება]
უჟანგბადო ბრომწყალბადმჟავის HBr გარდა, ბრომი ქმნის მთელ რიგ ჟანგბადიან მჟავეებს: ბრომმჟავას HBrO4, ქვებრომმჟავას HBrO3, ბრომოვანიმჟავას HBrO2, ქვებრომოვან მჟავას HBrO.
გამოყენება[რედაქტირება | წყაროს რედაქტირება]
ქიმიაში[რედაქტირება | წყაროს რედაქტირება]
- ნაერთები ბრომის საფუძველზე ძირითადად გამოიყენება ორგანულ სინთეზში.
ტექნიკაში[რედაქტირება | წყაროს რედაქტირება]
- ვერცხლის ბრომიდი AgBr გამოიყენება ფოტოგრაფიაში, როგორც შუქმგრძნობიარე ნივთიერება.
- გამოიყენება ანტიპირენების შესაქმნელად - დანამატი, რომელიც ანიჭებს ცეცხლგამძლეობას პლასტმასებს, ხის და საფეიქრო მასალებს.
- ბრომის პენტაფტორიდი ზოგჯერ გამოიყენება, როგორც ძლიერი დამჟანგველი სარაკეტო საწვავისათვის.
- 1,2-დიბრომმეთანი ამჟამად გამოიყენება, როგორც ანტიდეტონირებადი დანამატი საავტომობილო საწვავში, ტყვიის ტეტრაეთილენის ნაცვლად.
- ბრომიდების ხსნარები გამოიყენება ნავტობის მოსაპოვებლად.
მედიცინაში[რედაქტირება | წყაროს რედაქტირება]
- ბრომი გამოიყენება მედიცინაში. მისგან ამზადებენ მედიკამენტებს შინაგანი და გარეგანი მოხმარებისათვის. მედიცინაში ნატრიუმის ბრომიდი და კალიუმის ბრომიდი გამოიყენება, როგორც დამამშვიდებელი საშუალება.
იარაღის წარმოებაში[რედაქტირება | წყაროს რედაქტირება]
პირველი მსოფლიო ომის დროიდან ბრომი გამოიყენება, საბრძოლო მომწამლავი ნივთიერებების წარმოებისათვის.
ბიოლოგიური როლი[რედაქტირება | წყაროს რედაქტირება]
პრეპარატები, რომლებიც შექმნილია ბრომის საფუძველზე აქვეითებენ სექსუალურ ლიბიდოს და ამცირებენ პოტენციას, როგორც სხვა დამამშვიდებლები.
- ბრომიდები — დამამშვიდებელი და დამაძინებელი საშუალებებია.
- ბრომი შიდა სეკრეციის ჯირკვლებში გროვდება, და მისი ნაკლებობა ადამიანის ორგანიზმში იწვევს აღგზნების და დამუხრუჭების ნორმალური თანაფარდობის დარღღვევას.
ფიზიოლოგიური ზემოქმედება[რედაქტირება | წყაროს რედაქტირება]

თუკი ჰაერში ბრომის შემცველობა აღწევს 0.001 % კონცენტრაციას დაახლოებით (მოცულობით), იწვევს ლორწოვანი გარსის გაღიზიანებას, თავბრუსხვევას, ხოლო უფრო მაღლი კონცენტრაციები კი - სასუნთქი გზების სპაზმს, მოგუდვას. ბრომის ორთქლის ზღვრულად დასაშვები კონცენტრაციაა 0.5 მგ/მ3. ორგანიზმში მოხვედრისას ტოქსიკურ დოზას შეადგენს 3გ, ხოლო სასიკვდილო - 35 გ. ბრომის ორთქლით მოწამვლისას, დაზარალებული დაუყოვნებლივ უნდა გაიყვანონ სუფთა ჰაერზე, სუნთქვის აღდგენამდე, მცირე დროის განმავლობაში იყენებენ ტამპონებს, რომელიც გაჟღენთილია ნიშადურის სპირტით და რომელიც ხანმოკლე დროის განმავლობაში პერიოდულად მიაქვთ დაზარალებულის ცხვირთან. შემდგომი მკურნალობა კი უნდა გაგრძელდეს ექიმის მეთვალყურეობით. თხევადი ბრომის კანთან შეხება იწვევს მძიმე, მტკივნეულ და ხანგრძლივ მოუშუშებელ დამწვრობას.
ბრომის იონებია ტვინში, ჰიპოფიზში მაღალმოლეკულური ორგანული ნაერთის სახით. არსებობს აზრი იმის შესახებ, რომ ჰიპოფიზი ბრომ–ჰორმონს გამოყოფს, რომელსაც ცენტრალურ ნერვულ სისტემაში შეკავების უნარის აღდგენისა და გაძლიერების თვისება აქვს.
მუშაობის თავისებურებები[რედაქტირება | წყაროს რედაქტირება]
ბრომთან მუშაობისას უნდა გამოვიყენოთ სპეცტანსაცმელი (დამცავი ტანსაცმელი), აირწინაღი და სპეციალური ხელთათმანები. მისი მაღალი ქიმიური აქტიურობისა და ტოქსიკურობის გამო, როგორც აირადი ისე თხევადი ბრომი უნდა ინახებოდეს მინის, სქელკედლიან მჭიდროდ დახურულ ჭურჭელში. ბრომიან ჭურჭელს ინახავენ ქვიშით შევსებულ კონტეინერში, რომელიც ხელს უშლის შენჯღრევისას ბოთლის გატეხვას. ბრომის მაღალი სიმკვრივის გამო არავითარ შემთხვევაში არ შეიძლება ბრომიან ჭურჭელს მოვკიდოთ მხოლოდ ბოთლის ყელში (ბოთლის ყელი შეიძლება მოძვრეს და ბრომი დაიღვაროს იატაკზე).
დაღვრილი ბრომის ნეიტრალიზაციისათვის, ზედაპირზე უნდა მოვასხათ ნატრიუმის სულფიტის ხსნარი Na2SO3, ან ნატრიუმის კარბონატი Na2CO3
ზემოთ მითითებული რეაქციისათვის მიზანშეწონილია დავაყაროთ ნატრიუმის კარბონატი.
3Br2 + 3Na2CO3 → 5NaBr + NaBrO3+ 3CO2↑,
ან სველი საჭმლის სოდა:
6NaHCO3+3Br2=NaBrO3+5NaBr+6CO2+3H2O
მითები და ლეგენდები[რედაქტირება | წყაროს რედაქტირება]
არსებობს ფართოდ გავრცელებული ლეგენდა იმაზე, რომ ჯარში თითქოს საჭმელში უმატებენ ბრომს სექსუალური სურვილების შესამცირებლად. ამ მითს არ გააჩნია არავითარი საფუძველი - სურვილების დაქვეითება წარმატებით ხორციელდება ფიზიკური დატვირთვით, ხოლო სინამდვილეში საჭმელში დანამატის სახით ხშირად უმატებენ ასკორბინის მჟავას ავიტამინოზის პრევენციისათვის. გარდა ამისა, ბრომის პრეპარატები მლაშე გემოს მატარებლები არიან და არ ახდენენ გავლენას პოტანციაზე. მათ გააჩნიათ დამამშვიდებელი და დასაძინებელი ეფექტი.
რესურსები ინტერნეტში[რედაქტირება | წყაროს რედაქტირება]
- ბრომი WebElements.com
- ბრომი ქიმიური ელემენტების პოპულარული ბიბლიოთეკა დაარქივებული 2016-12-13 საიტზე Wayback Machine.
- ბრომის თბოგამტარობის გრაფიკი დაარქივებული 2010-01-06 საიტზე Wayback Machine.
- ბრომის სიბლანტე გარკვეულ პირობებში დაარქივებული 2010-01-06 საიტზე Wayback Machine.
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ დოლიძე ვ., ციციშვილი ვ., „ოთხენოვანი ქიმიური ლექსიკონი“, თბ., 2004, გვ. 34
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 2, თბ., 1977. — გვ. 534.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
| ქიმიურ ელემენტთა პერიოდული სისტემა | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| 8 | 119 | 120 | ⁂ | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 | ||||||||||
| ⁂ | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||


