ორგანული ქიმია

ორგანული ქიმია — მეცნიერება, რომელიც შეისწავლის ნახშირბადის ნაერთებს,[1] გამონაკლისებია: ნახშირბადის ოქსიდები, ნახშირმჟავა, ნახშირმჟავას მარილების (კარბონატები), კარბიდები და ციანიდები ამ ნახშირბადის ნაერთებს შეისწავლის არაორგანული ქიმია. მეორე განმარტების თანახმად, ორგანული ქიმია არის მეცნიერება, რომელიც შეისწავლის ნახშირწყალბადებსა და მათ ნაწარმებს.
ნახშირბადის განსაკუთრებული ბუნება, რომლითაც იგი გამოირჩევა სხვა ქიმიური ელემენტებისაგან გამოიხატება ნახშირბადატომების ერთმანეთთან და სხვა ატომებთან შეერთებაში მარტივი, ორმაგი და სამმაგი ბმით. გარდა ამისა, ნახშირბადს აქვს უნარი წარმოქმნას მდგრადი გრძელი, სწორი და განტოტვილჯაჭვიანი ნაერთები. ეს ნაერთები შეიძლება იყოს ღია და დახურულჯაჭვიანი. ღია და დახურულჯაჭვიან ნაერთებში ნახშირბადი შეიძლება უშუალოდ იყოს დაკავშირებული სხვა ელემენტის ატომებთან ანუ ჰეტეროატომებთან როგორებიც არის მაგალითად ჟანგბადი, გოგირდი, აზოტი, ფოსფორი და სხვა.
გარდა ამისა თანამედროვე კვლევების დროს ყურადღება გამახვილებული არის ორგანომეტალურ ნივთიერებებზე, ორგანული ნაერთები რომლებიც შეიცავენ ლითონებს მაგალითად ლანთანოიდებს, მაგრამ განსაკუთრებით გარდამავალ ლითონებს როგორებიცაა თუთია, სპილენძი, პალადიუმი, ნიკელი, კობალტი, ტიტანი და ქრომი.
ორგანული ნივთიერება შეისწავლის ორგანულ ნივთიერებებს განსხვავებით არაორგანული ქიმიისგან.
ორგანული და არაორგანული ქიმიის გაყოფა მომდინარეობს იქიდან, რომ მე-19 საუკუნის დასაწყისამდე ფიქრობდნენ, რომ არაორგანული ნაერთებისაგან განსხვავებით, შეუძლებელი იყო ორგანული ნაერთების წარმოქმნა ე.წ. სასიცოცხლო ძალის გამოყენების გარეშე. მას შემდეგ რაც 1828 წელს ფრიდრიხ ვიოლერმა ასინთეზა შარდოვანა.[2][3] ზემოხსენებულ შეხედულებას საფუძველი გამოეცალა. თუმცაღა ორგანული ქიმიისა და არაორგანულ ქიმიის დარგები გაყოფილი დარჩა. ეს შეიძლება გამართლდეს იმით, რომ ორგანული ნაერთები არაორგანული ნაერთებისაგან დიდად განსხვავდებიან მრავალმხრივ — შედარებით ნაკლები მდგრადობა ტემპერატურისადმი, მათი მიღებისა და შესწავლის ხერხების თავისებურება და ა. შ.
ორგანული ნაერთები მნიშვნელოვანია ყველა ცოცხალი ორგანიზმისთვის რათა მათ იარსებონ, მაგრამ ასევე ისინი წარმოადგენენ მრავალი კომერციული პროდუქტის საფუძველს მედიკამენტებში, ნავთობქიმიაში, აგროქიმიაში. მათგან მზადდება საპოხი მასალები, ორგანული გამხსნელები, საწვავები, პოლიმერები ასაფეთქებლები და სხვა უამრავი პროდუქტი. ორგანული ქიმია მოიცავს არა მარტო ორგანულმეტალურ ქიმიას და ბიოქიმიას, არამედ პოლიმერების ქიმიას, ნივთიერების თვისებებს და ფარმაცეპტიკულ ქიმიას[1].

|

|

|
| ხაზოვანი | ბურთულოვან-ღეროვანი | სივრცე შევსებული |
|
სტეროიდული ჰორმონის 5α-დიჰიდროპროგესტერონის(5α-DHP) ორგანული მოლეკულის წარმოდგენა სამი სხვადასხვა სახით.მოლეკულები რომლებიც გვიჩვენებენ ფერს, ნახშირბადის ატომები აღნიშნულია შავი ფერით, წყალბადები ნაცრისფერით, ხოლო ჟანგბადები წითლით. მოლეკულა რომელიც არ გვიჩვენებს ფერებს, მაგალითდ ხაზოვანი ამშემთხვევაში მოლეკულის ყველა კუთხეში იგულისხმება ნახშირბადი იმდენი წყალბადით რამდენის მიერთებაც მას შეუძლია. | ||
ისტორია[რედაქტირება | წყაროს რედაქტირება]

XIX საუკუნემდე ქიმიკოსები ზოგადად თვლიდნენ, რომ ცოცხალი ორგანიზმებისგან მიღებული ნაერთები დაჯილდოებული იყო სასიცოცხლო ძალებით, რაც მათ განასხვავებდა არაორგანული ნაერთებისგან. ვიტალიზმის კონცეფციის (სასიცოცხლო ძალის თეორიის) თანახმადაც ორგანული ნივთიერებები დაჯილდოვებული იყვნენ "სასიცოცხლო ძალით"[4].
XIX საუკუნის პირველი ნახევრის განმავლობაში მიმდინარეობდა ორგანული ნაერთების პირველი სისტემატური შესწავლა.1816 წ. მიშელ შევრელმა დაიწყო სხვადასხვა ცხიმებისა და ტუტეებისგან საპნის დამზადება და მიღების ხერხების შესწავლა. მან გამოყო სხვადასხვა მჟავები და ტუტეები რომლებიც წარმოადგენენ საპნის შემადგენელ კომპონენტებს. ამით მან დაამტკიცა რომ სხვადასხვა ცხიმებში შესაძლებელია ცვლილებების შეტანა და ამისთვის სულაც არ არის საჭირო ცოცხალი ორგანიზმი. 1828 წელს ფრიდრიხ ვიოლერმა მიიღო ორგანული ნაერთი შარდოვანა(კარბამიდი), რომელიც შედის შარდის შემადგენლობაში, მან საწყის ნივთიერებებად გამოიყენა არაორაგნული ნივთიერებები(კალიუმის ციანატი და ამონიუმის სულფატი), დღეს ამ სინთეზის მეთოდს ვიოლერის სინთეზს უწოდებენ. ეს მოვლენა კი არღვევს ვიტალიზმის დოქტრინას[5].
1856 წელს უილიამ ჰენრი პერკინმა, როდესაც ქუინინის წარმოება სცადა, შემთხვევით მიიღო ორგანული საღებავი. მისმა აღმოჩენამ, რომელმაც მას ასევე ფინანსური წარმატებაც მოუტანა, სხვების თვალში მნიშვნელოვნად გაზარდა ინტერესი ორგანული ქიმიის მიმართ[6].
ორგანული ქიმიისათვის მნიშვნელოვანი მიღწევა იყო ქიმიური სტრუქტურის ცნების დამკვიდრება, რომელიც ერთმანეთისგან დამოუკიდებლად შეიმუშავეს ფრიდრიხ ავგუსტ კეკულემ და არჩიბალდ სკოტ კუპერმა 1858 წელს[7]. ორივე მათგანი ფიქრობდა რომ ტეტრავალენტურ(ანუ ოთხ ვალენტიან) ნახშირბად ატომს შეეძლო ნახშირბადოვანი ქსელის წარმოქმნა[8].

ფარმაცევტული ინდუსტრიის ხანა დაიწყო მე -19 საუკუნის ბოლო ათწლეულში, როდესაც გერმანიაში აცეტილსალიცილმჟავის (უფრო ხშირად გამოიყენება ტერმინი ასპირინი) წარმოება დაიწყო ფარმაცევტულმა კომპანია ბაიერმა[9].
1910 წლისთვის პოლ ერლიჩმა და მისმა ლაბორატორიულმა ჯგუფმა დაიწყო დარიშხანზე დაფუძნებული არსფენამინის მიღება, არსფენამინი კი გახდა სიფილისის პირველი ეფექტური სამკურნალო საშუალება[10]. მისმა ლაბორატორიამ გადამწყვეტი როლი ითამაში თერაპიული შრატების სტანდარტიზაციაში და დიფტერიის საწინააღმდეგოდ[11].
რთული ორგანული ნაერთების მრავალსაფეხურიან სინთეზს მთლიანი სინთეზი ეწოდება. XX საუკუნის დასაწყისიდან, გაიზარდა მთლიანი სინთეზის სირთულე, რაც მოიცავს მაღალი სირთულის მოლეკულების მიღებას, როგორიცაა ლიზერგინული მჟავა და ვიტამინი B12[12].
ნავთობის აღმოჩენამ და ნავთობქიმიური ინდუსტრიის განვითარებამ თავისმხრივ ხელი შეუწყო ორგანული ქიმიის განვითარებასაც. ინდივიდუალური ნავთობპროდუქტების ნაერთების სხვადასხვა სახის ნაერთებში სხვადასხვა ქიმიური პროცესების შედეგად გადაქცევამ და ამ ორგანულმა რეაქციებმა განაპირობეს სამრეწველო და კომერციული პროდუქციის ფართო სპექტრი.
ვინაიდან ბიოლოგიურ ორგანიზმებში ქიმიური ნაერთების უმეტესი ნაწილი, ფაქტობრივად ნახშირბადის ნაერთებია, ამიტომ ორგანულ ქიმიასა და ბიოქიმიას შორის კავშირი იმდენად მჭიდროა, რომ ბიოქიმია შეიძლება ჩაითვალოს ორგანული ქიმიის დარგად.
თვისებები[რედაქტირება | წყაროს რედაქტირება]
ჩვეულებრივ, საინტერესოა ორგანულ ნაერთთა ფიზიკური თვისებები, რაც მოიცავს როგორც რაოდენობრივ, ასევე თვისებრივ მახასიათებლებს. ინფორმაცია მოიცავს დნობის ტემპერატურას, დუღილის ტემპერატურას და რეფრაქციის ინდექსს. თვისებები კი სუნს, თანმიმდევრულობას, ხსნადობას და ფერს.
დნობის და დუღილის თვისებები[რედაქტირება | წყაროს რედაქტირება]
ორგანული ნივთიერებები დნება და მალევე დუღს, განსხვავებით არაორგანული ნაერთებისა რომლებიც შეიძლება იყვნენ გამდნარ მდგომარეობაში მაგრამ არ დუღდნენ რადგან ზოგადად ორგანულ ნაერთებს გააჩნიათ უფრო დაბალი დნობის და დუღილის ტემპერატურები ვიდრე არაორგანულ ნაერთებს. დნობის და დუღლის ტემპერატურები დამოკიდებულია მოლეკულის პოლარულობაზე და მის მოლეკულურ მასაზე. როგორც წესი ორგანული ნაერთები არ არიან სტაბილურები 300 °C- ზე ზემოთ ტემპერატურაზე, თუმცა არსებობენ გამონაკლისებიც.
ხსნადობა[რედაქტირება | წყაროს რედაქტირება]
ნეიტრალური ორგანული ნაერთები ჰიდროფობურები არიან, ანუ ისინი წყალში უფრო ნაკლებად იხსნებიან, ვიდრე ორგანულ გამხსნელებში. წყალში იხსნებიან ისეთი ორგანული ნივთიერებები რომლებსაც შეუძლიათ იონებად გადაქცევა ან დაბალი მოლეკულური მასის მქონე ნივთიერებები, რომლებიც წყალთან წყალბადურ ბმებს ამყარებენ, ასეთი ნაერთებია: სპირტები, ამინები და კარბოქსილის მჟავები. ორგანული ნივთიერებები ორგანულ გამხსნელებში იხსნებიან. გამხსნელები შეიძლება იყოს ნივთიერებები, როგორიცაა ეთერი ან ეთილის სპირტი, ან ნარევები, მაგალითად პარაფინური გამხსნელები, სხვადასხვა ნავთობის ეთერები და ტურპენტინის ხსნარი. სხვადასხვა გამხსნელებში ხსნადობა დამოკიდებულია გამხსნელის ტიპზე და ფუნქციონალურ ჯგუფებზე.
ნომენკლატურა[რედაქტირება | წყაროს რედაქტირება]

სისტემური ნომენკლატურა მოცემულია IUPAC– ის სპეციფიკაციით. სისტემური ნომენკლატურით ნივთიერების დასახელება იწყება მშობელი მოლეკულის სტრუქტურული სახელით. მშობელი მოლეკულის სახელს მოსდევს პრეფიქსები სუფიქსები და ციფრები, მაგრამ იმის გათვალისწინებით, რომ დღეისათვის ცნობილია მილიონობით ორგანული ნაერთი, სისტემური სახელების მკაცრი გამოყენება ხდება რთული. ამრიგად, IUPAC- ის რეკომენდაციებს უფრო მკაცრად იცავენ მარტივი ნაერთებისთვის, მაგრამ არა რთული მოლეკულებისთვის.
არასისტემატიკური ნომენკლატურა უფრო მარტივი და ერთმნიშვნელოვანია, ყოველ შემთხვევაში ორგანული ქიმიკოსებისთვის. არასისტემატიკური სახელები არ მიუთითებს ნაერთის სტრუქტურაზე. მაგალითად არაფორმალურად დასახელებულ ლიზერგინული მჟავის დიეთილამიდს ასახელებენ (6aR, 9R) -N, N-დიეთილ-7-მეთილ-4,6,6a, 7,8,9-ჰექსაჰიდროინდოლო-[4,3-fg] ქუინოლინი-9-კარბოქსამიდი.
ნაერთების დასახელებისთვის ასევე ხელსაყრელი ფორმატებია „SMILES“ და „InChI“.
სტრუქტურები[რედაქტირება | წყაროს რედაქტირება]
ორგანულ მოლეკულებს უფრო ხშირად აღწერენ ნახაზებით, სტრუქტურული ფორმულებით ან ქიმიური ფორმულების საშუალებით. ხაზოვანი ფორმულა მარტივი და ერთმნიშვნელოვანია. ამ სისტემაში, თითოეული ხაზის ბოლო კუთხის წერტილები და კვეთა წარმოადგენს ერთ ნახშირბადს, ხოლო წყალბადის ატომები შეიძლება არ ჩანდეს, მაგრამ იყოს ნაგულისხმევი იმის მიხედვით თუ რამდენ წყალბადს მიიერთებდა ტეტრავალენტული ნახშირბადი.

ისტორია[რედაქტირება | წყაროს რედაქტირება]
1880 წლისთვის აღმოჩენილმა ქიმიური ნაერთების რაოდენობამ ახალი სინთეზური და ანალიტიკური ტექნიკის საშუალებით აფეთქება მოახდინა ქიმიაში. კონვენციის არარსებობამ გამოიწვია ორგანულ ნივთიერებებისს დასახელების პრობლემები, ამან კი თავისმხრივ გამოიწვია ჟენევის წესების შექმნა 1892 წელს[13].
ორგანული ნაერთების კლასიფიკაცია[რედაქტირება | წყაროს რედაქტირება]

ფუნქციონალური ჯგუფები[რედაქტირება | წყაროს რედაქტირება]
ფუნქციონალური ჯგუფების კონცეფცია უმთავრესია ორგანულ ქიმიაში, როგორც სტრუქტურების კლასიფიკაციისთვის, ასევე თვისებების პროგნოზირებისთვის.
ფუნქციონალურ ჯგუფებს შეუძლიათ გადამწყვეტი გავლენა მოახდინონ ორგანული ნაერთების ქიმიურ და ფიზიკურ თვისებებზე. მოლეკულები კლასიფიცირდება მათი ფუნქციონალური ჯგუფების საფუძველზე. მაგალითად, სპირტების ფუნქციონალური ჯგუფია R−ОН სადაც „R“ არის რადიკალი. ყველა სპირტს აქვს მსგავსი თვისებები ყველა მათგანი არის ჰიდროფილური (ანუ წყალში კარგად ხსნადი(, ყველა წარმოქმნის ესტერებს და გადადიან შესაბამის ჰალიდებში.
ფუნქციონალური ჯგუფები შეიცავენ ჰეტეროატომებს (ატომებს, გარდა C და H-ისა). ორგანული ნაერთები კლასიფიცირდება ფუნქციური ჯგუფებით როგორც არის ალკოჰოლების, კარბოქსილის მჟავების, ამინების და სხვა ნაერთების შემთხვევაში.
ალიფატური ნაერთები[რედაქტირება | წყაროს რედაქტირება]
ალიფატური ნახშირწყალბადები მათი გაჯერების მდგომარეობის მიხედვით ჰომოლოგიურ სერიათა სამ ჯგუფად იყოფა ესენია:
- ალკანები : ალიფატური ნახშირწყალბადები რომლებიც არ შეიცავენ არანაირ ორმაგ და სამმაგ ბმებს, შეიცავენ მხოლოდ C-C და C-H ერთმაგ ბმებს
- ალკენები : ალიფატური ნახშირწყალბადები რომლებიც შეიცავენ ერთ ან ერთზე მეტ ორმაგ ბმას(ნახშირწყალბადი რომელიც შეიცავს ორ ორმაგ ბმას დიენი ეწოდება).
- ალკინები : ალიფატური ნახშირწყალბადები შეიცავენ ერთ ან ერთზე მეტ სამმაგ ბმებს.
ყველა სხვა ალიფატური ნახშირწყალბადები კლასიფიცირდებიან ამ ჯგუფების მიხედვით . ასეთი ნაერთები შეიძლება იყოს სწორხაზოვანი, გატოტვილი ან ციკლური.
არომატული ნაერთები[რედაქტირება | წყაროს რედაქტირება]
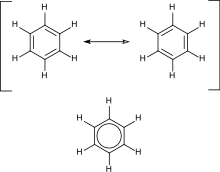
არომატული ნახშირწყალბადები შეიცავენ ორმაგ ბმებს მონაცვლეობით. ეს ნიშნავს, რომ ციკლში ყველა ნახშირბადის ატომი არის sp2 ჰიბრიდიზაციაში, არომატული ნახშირწყალბადების ყველაზე მნიშვნელოვანი მაგალითია ბენზოლი, რომლის სტრუქტურა ჩამოაყალიბა კეკულემ.
ჰეტეროციკლური ნაერთები[რედაქტირება | წყაროს რედაქტირება]
ციკლური ნახშირწყალბადების თვისებები მკვეთრად იცვლება, თუ ციკლი შეიცავს ჰეტეროატომს. თავისმხრივ თვისებებით განსხვავდებიან ჰეტეროციკლური ნაერთებიც. პირიდინი და ფურანი არომატული ჰეტეროციკლებია, ხოლო პიპერიდინი და ტეტრაჰიდროფურანი ალიციკლური.ჰეტეროციკლური მოლეკულების ჰეტეროატომები ძირითადად არის ჟანგბადი, გოგირდი ან აზოტი, ეს უკანასკნელი განსაკუთრებით გავრცელებულია ბიოქიმიურ სისტემაში.
ჰეტეროციკლები ჩვეულებრივ გვხვდება პროდუქციის ფართო სპექტრში, მათ შორისაა ანლინის საღებავები და მედიკამენტები. გარდა ამისა, ისინი ფართოდ გავრცელებულია ბიოქიმიური ნაერთებში, მაგალითად, ალკალოიდებში, ვიტამინებში, სტეროიდებში და ნუკლეინის მჟავებში (მაგ; დნმ, რნმ).
პოლიმერები[რედაქტირება | წყაროს რედაქტირება]

ნახშირბადის ერთი მნიშვნელოვანი თვისება არის ის, რომ ის ადვილად წარმოქმნის ჯაჭვებს, რომლებიც კავშირდებიან ნახშირბად-ნახშირბადული (ნახშირბადიდან-ნახშირბადამდე) ბმებით. დამაკავშირებელ პროცესს პოლიმერიზაცია ეწოდება, ხოლო ჯაჭვებს ანუ ქსელებს პოლიმერები ეწოდება. პოლიმერები შედგებიან მონომერებისგან.
არსებობს პოლიმერების ორი ძირითადი სახე: სინთეზური პოლიმერები და ბიოპოლიმერები. სინთეზური პოლიმერები ხელოვნურად იწარმოება და მათ სამრეწველო პოლიმერებს უწოდებენ[14]. ბიოპოლიმერები კი წარმოიქმნებიან ბუნებრივ პირობებში.
სინთეზური ორგანული პოლიმერებია პოლიეთილენი (პოლიეთენი), პოლიპროპილენი, ნეილონი, ტეფონი (PTFE), პოლისტიროლი, პოლიესტერი, პოლიმეთილმეთაკრილატი და პოლივინილქლორიდი (PVC).პოლიმერიზაციის პირობების შეცვლა ცვლის პროდუქტის ქიმიურ შემადგენლობას და მის თვისებებს. ამ ცვლილებებში შედის ჯაჭვის სიგრძე ან განშტოებები.
ბიომოლეკულები[რედაქტირება | წყაროს რედაქტირება]
ბიომოლეკულური ქიმია არის მთავარი კატეგორია ორგანულ ქიმიაში, რომელსაც ხშირად სწავლობენ ბიოქიმიკოსები. მრავალი რთული მრავალფუნქციური ჯგუფის მოლეკულაა საჭირო ცოცხალი ორგანიზმების არსებობისთვის. ზოგიერთი გრძელ ჯაჭვიანი ბიოპოლიმერია და მასში შედის პეპტიდები, დნმ, რნმ და პოლისაქარიდები როგორიცაა ცხოველებში სახამებელი და მცენარეებში ცელულოზა.
დანარჩენი ძირითადი კლასებია: ამინომჟავები(საჭირო არის პეპტიდების და პროტეინების შესაქმნელად), ნახშირწყლები (რომელშიც შედის პოლისაქარიდები), ნუკლეინის მჟავები (რომელიც მოიცავს დნმ-ს და რნმ-ს, როგორც პოლიმერებს), და ლიპიდები. ცხოველებში იზოპრენები ქმნიან მნიშვნელოვან სტეროიდულ სტრუქტურულ (ქოლესტერინს) და სტეროიდულ ჰორმონულ ნაერთებს; ხოლო მცენარეებში წარმოიქმნება ტერპენები, ტერპენოიდები, ზოგიერთი ალკალოიდები და ნახშირწყალბადების კლასი, ბიოპოლიმერები, რომლებიც გვხვდება მცენარეთა სხვადასხვა სახეობის ლატექსში, ასეთი ბიოპოლიმერებისგან ამზადებენ რეზინს.
პატარა მოლეკულები[რედაქტირება | წყაროს რედაქტირება]

ფარმაკოლოგიაში, ორგანული ნაერთების მნიშვნელოვანი ჯგუფი არის მცირე მოლეკულები, რომელსაც ასევე მოიხსენიებენ, როგორც ”მცირე ორგანულ ნაერთებს”. მცირე მოლეკულა არის პატარა ორგანული ნაერთი, რომელიც ბიოლოგიურად აქტიურია, მაგრამ არ არის პოლიმერი. პრაქტიკაში, მცირე მოლეკულების მოლური მასა არ აღემატება 1000 გ/მოლს.
ფულერენები[რედაქტირება | წყაროს რედაქტირება]
ფულერენები და ნანოტუბები წარმოადგენენ ნახშირბადის ალოტროპიას აქვთ სფერული და მილის ფორმის მოლეკულური ფორმები. პირველად ფულერენი აღმოჩენილი იქნა 1985-წელს ჰარი კროტოს მიერ დიდი ბრიტანეთიდან და რიჩარდ სმალის და რობერტ კარლ უმცროსის მიერ ამერიკის შეერთებული შტატებიდან.
ორგანული რეაქციები[რედაქტირება | წყაროს რედაქტირება]
ორგანული რეაქციები ოყოფა სამ ძირითად ტიპად ესენია: მიერთების, მოხლეჩის და ჩანაცვლების რეაქციები. ქვემოთ მაგალითად მოყვანილი არის ჩანაცვლების რეაქცია:
- Nu− + C-X → C-Nu + X−
სადაც X არის რომელიმე ფუნქციონალური ჯგუფი და Nu არის ნუკლეოფილი. შესაძლო ორგანული რეაქციების რაოდენობა უსასრულოა, მაგრამ რეაქციები თავმოყრილია ჯგუფეფში რომლებიც ნივთიერებებს აერთიანებენ რეაქციების საერთო თვისებებით. თითოეულ რეაქციას აქვს ეტაპობრივი რეაქციის მექანიზმი, რომელიც განმარტავს, თუ როგორ ხდება ყველაფერი თანმიმდევრობით, თუმცა რეაქციის დეტალური აღწერა ყოველთვის არ არის ნაჩვენები.
ნებისმიერი რეაქციის ეტაპები წარმოდგენილი არის სწორი ისრებით, ხოლო მოღუნული ისრები გამოიყენება ელექტრონული წყვილის გადაადგილების საჩვენებლად.
ორგანული სინთეზი[რედაქტირება | წყაროს რედაქტირება]
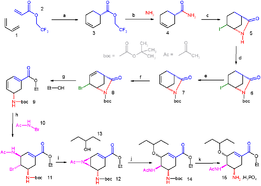
ახალი ნაერთის ორგანული სინთეზი არის პრობლემის გადაჭრის საშუალება, სადაც სინთეზის ხერხი განკუთვნილია სამიზნე მოლეკულის მისაღებად, ოპტიმალური საწყისი მასალისგან ოპტიმალური რეაქციების არჩევით.
კომპლექსურ ნაერთებს შეიძლება ჰქონდეთ ათობით რეაქციის ეტაპი, რითც თანმიმდევრულად მიიღება სასურველი მოლეკულა. სინთეზი მიმდინარეობს მოლეკულაში ფუნქციონალური ჯგუფების აქტიურობის მიხედვით. რთული მოლეკულების ახალი სინთეზური საშუალებების შექმნის სამეცნიერო პრაქტიკას ეწოდება ტოტალური სინთეზი.
სინთეზის შემუშავების სტრატეგია მოიცავს რეტროსინთეზს. ყველაფერი იწყება სამიზნე მოლეკულისგან რომლის მიღებაც არის საჭირო, შემდეგ ხდება მოლეკულის მცირე ნაწილებად დაშლა და იმის ჩვენება თუ როგორ არის შესაძლებელი სამიზნე მოლეკულის მიღება. ეს ქმნის "სინთეზურ ხეს", რადგან თითოეულ ნაერთს და აგრეთვე თითოეულ წინამორბედ ნაერთებს ასევე აქვთ მრავალი სინთეზის ხერხი. ასე ვთქვათ ეს არის სინთეზის ტიპი რომელიც მიმდინარეობს პირიქით.
გარე ბმულები[რედაქტირება | წყაროს რედაქტირება]
- MIT.edu, OpenCourseWare: Organic Chemistry I
- HaverFord.edu, Organic Chemistry Lectures, Videos and Text
- Organic-Chemistry.org, Organic Chemistry Portal – Recent Abstracts and (Name)Reactions
- Orgsyn.org, Organic Chemistry synthesis journal
- Khanacademy.org, Khan Academy - Organic Chemistry
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ 1.0 1.1 Clayden, J.; Greeves, N. and Warren, S. (2012) Organic Chemistry. Oxford University Press. pp. 1–15. ISBN 0-19-927029-5.
- ↑ Wöhler, Friedrich (1828) "Ueber künstliche Bildung des Harnstoffs" (On the artificial formation of urea), Annalen der Physik und Chemie, 88 (2) : 253–256. Available in English at: Chem Team.
- ↑ Gibb BC (April 2009). „Teetering towards chaos and complexity“. Nature Chemistry. 1 (1): 17–8. Bibcode:2009NatCh...1...17G. doi:10.1038/nchem.148. PMID 21378787.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements, 2nd, Butterworth-Heinemann. ISBN 0-08-037941-9.
- ↑ Henry Marshall Leicester (1951). A Source Book in Chemistry, 1400-1900. Harvard University Press, გვ. 309.
- ↑ Kiefer, D. M. (1993). „Organic Chemicals' Mauve Beginning“. Chem. Eng. News. 71 (32): 22–23. doi:10.1021/cen-v071n032.p022.
- ↑ August Kekulé and Archibald Scott Couper (June 2016). დაარქივებულია ორიგინალიდან — 21 მარტი 2018. ციტირების თარიღი: 20 March 2018.
- ↑ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (2017). Introduction to Organic Chemistry. New Delhipages=3–4: Medtech (Scientific International, reprint of revised 4th edition, Macmillan, 1998). ISBN 978-93-85998-89-8.
- ↑ Roberts, Laura (7 December 2010) History of Aspirin დაარქივებული 2014-10-08 საიტზე Wayback Machine. . The Telegraph
- ↑ Bosch F & Rosich L (2008). „The contributions of Paul Ehrlich to pharmacology: A tribute on the occasion of the centenary of his Nobel Prize“. Pharmacology. 82 (3): 171–9. doi:10.1159/000149583. PMC 2790789. PMID 18679046.CS1-ის მხარდაჭერა: იყენებს ავტორის პარამეტრს (link)
- ↑ Paul Ehrlich (June 2016). ციტირების თარიღი: 20 March 2018.
- ↑ (1996) Classics in Total Synthesis: Targets, Strategies, Methods. John Wiley & Sons. ISBN 978-3-527-29231-8.
- ↑ Evieux, E. A. (1954-06-01). „The Geneva Congress on Organic Nomenclature, 1892“. Journal of Chemical Education. 31 (6): 326. Bibcode:1954JChEd..31..326E. doi:10.1021/ed031p326. ISSN 0021-9584.
- ↑ "industrial polymers, chemistry of." Encyclopædia Britannica. 2006
| |||||||||||||||||


