კისტური ფიბროზი
| კისტური ფიბროზი | |
|---|---|
 | |
| დარგი |
medical genetics, პედიატრია, პულმონოლოგია |
| კლასიფიცირება და გარე წყაროები | |
| DiseasesDB | 3347 |
| ICD-10 | E84. |
| ICD-9 | 277.0 |
| OMIM | 219700 |
| MedlinePlus | 000107 |
| eMedicine | eMedicine: article/1001602 |
| Patient UK | კისტური ფიბროზი |
| MeSH | D003550 |
| GeneReviews | |
კისტური ფიბროზი (CF), აგრეთვე ცნობილი როგორც მუკოვისციდოზი — გენეტიკური დაავადება, რომელიც ყველაზე მეტად აზიანებს ფილტვებს, ასევე თირკმელებს, პანკრეასს, ღვიძლსა და ნაწლავებს.[1][2] შორსწასულ გართულებებს მიეკუთვნება მწვავე რესპირაციული ინფექციები სუნთქვის გაძნელებითა და ლორწოს ინტენსიური ამოხველებით. სხვა სიმპტომებია: სინუსების (ძვლოვანი წიაღების) ანთება, ზრდაში შეფერხება, სტეატორეა (ცხიმები განავალში), დოლის ჩხირის მაგვარი თითები, უნაყოფობა (განსაკუთრებით მამაკაცებში). ინდივიდებს შეიძლება ჰქონდეთ განსხვავებული ხარისხის კლინიკური გამოვლინებები (ალელური ჰეტეროგენურობა).[1]
CF აუტოსომურ-რეცესიული დაავადებაა, რაც გამოწვეულია კისტური ფიბროზის ტრანსმემბრანული გამტარობის მარეგულირებელი ცილის (CFTR) გენის ორივე ასლში მომხდარი მუტაციით.[1] ერთი მუტანტური ასლის მქონე ინდივიდები არიან კლინიკურად ჯანმრთელები, მაგრამ დაავადების მატარებლები.[3] CFTR მონაწილეობს ოფლის, საჭმლის მომნელებელი სითხეებისა და ლორწოს წარმოქმნაში.[4] როდესაც CFTR არ ფუნქციონირებს, აღნიშნული სეკრეტები (რომლებიც ნორმაში თხელია) სქელდება.[5] დაავადების დიაგნოზის დასმისთვის კეთდება ოფლის ანალიზი და გენეტიკური ტესტირება.[1] მსოფლიოს ზოგიერთ ქვეყანაში ინტენსიურად მიმდინარეობს დაავადების სკრინინგი ახალშობილებში დაბადებისთანავე.[1]
კისტური ფიბროზისგან სრული განკურნების საშუალებები არ არსებობს.[3] ფილტვის ინფექციებს მკურნალობენ ანტიბიოტიკებით, რომლებსაც პაციენტებს აწვდიან ინტრავენური ინექციის სახით, პერორალურად (ტაბლეტირებული სახით) ან ინჰალაციით. ზოგჯერ ხანგრძლივად გამოიყენება ანტიბიოტიკი აზიტრომიცინი. ჰიპერტონული ხსნარისა და სალბუტამოლის ინჰალაციამ შეიძლება შეამსუბუქოს მდგომარეობა. ფილტვის ტრანსპლანტაცია შეიძლება იყოს გამოსავალი მისი ფუნქციონირების უკიდურესი დაქვეითებისას. პანკრეასული ფერმენტების ჩანაცვლება და ცხიმში ხსნადი ვიტამინების ხელოვნურად მიწოდება მნიშვნელოვანია, განსაკუთრებით ადრეულ ასაკში. ადამიანების უმრავლესობა იყენებს სასუნთქი გზების გაწმენდის საშუალებებს, როგორიცაა გულმკერდის ფიზიოთერაპია.[1] სიცოცხლის საშუალო ხანგრძლივობა განვითარებულ ქვეყნებში 35-დან 50 წლამდე მერყეობს.[6] კისტური ფიბროზით დაავადებულთა 80 % იღუპება ფილტვის პრობლემებით.[1]
კისტური ფიბროზი ყველაზე ხშირად ჩრდილოეთ ევროპულ პოპულაციაში გვხვდება, სადაც ყოველი 3 000 ახალშობილიდან ერთი დაავადებულია (1:3000),[1] ხოლო ყოველი 25-დან ერთი მატარებელია (1:25).[3] ნაკლებად ხშირია აფრიკელებსა და აზიელებში.[1] დაავადება პირველად 1938 წელს დაახასიათა დოროთი ანდერსენმა.[2] სახელწოდება კისტური ფიბროზი უკავშირდება დაავადების მახასიათებელ ფიბროზსა და ცისტების ფორმირებას პანკრეასში.[2][7]
სიმპტომები და ნიშნები

კისტური ფიბროზის ძირითდი ნიშანი და სიმპტომი არის მარილიანი კანი,[8] შეზღუდული ზრდა, წონაში კლება მიუხედავად ნორმალური კვებისა,[9] სქელი და წებოვანი ლორწოს დაგროვება,[10] ხშირი რესპირატორული ინფექციები, ხველა და სუნთქვის გაძნელება.[11] კაცები შეიძლება უნაყოფოები იყვნენ თესლის გამომტანი სადინრის განუვითარებლობის გამო.[12] სიმპტომები, როგორიცაა მეკონიუმის გაუვალობით ნაწლავების ობსტრუქცია მჟღავნდება ახალშობილებში.[13] ბავშვებმა ზრდასთან ერთად უნდა ივარჯიშონ, რათა გამოათავისუფლონ ლორწო ალვეოლებში.[14] წამწამოვან ეპითელურ უჯრედებს აქვთ მუტანტური ცილა, რომელიც ვერ უზრუნველყოფს ლორწოს თხევადობის შენარჩუნებას.[10] ბავშვებში ზრდის შეფერხება ვლინდება თანატოლების მსგავსად წონაში ან სიმაღლეში მომატების შეუძლებლობით და დაავადების დიაგნოზირება მხოლოდ მაშინ ხდება, როდესაც იწყებენ ამ ჩამორჩენის მიზეზების გარკვევას. ზრდის შეფერხების გამომწვევია მრავალი ფაქტორი მათ შორის ფილტვების ქრონიკული ინფექციები, კუჭ-ნაწლავის ტრაქტში ნივთიერებების შემცირებული ადსორბცია და მეტაბოლიზმის გაზრდილი მოთხოვნილება ქრონიკული ავადობის გამო.[9]
იშვიათ შემთხვევებში, კისტური ფიბროზი შეიძლება მანიფესტირდეს, როგორც კოაგულაციური (სისხლის შედედების) დარღვევა. ბავშვი K ვიტამინს ნორმაში დედის რძიდან, მოგვიანებით კი მყარი საკვებიდან იღებს. ეს პროცესი დარღვეულია კისტური ფიბროზით დაავადებულ ზოგიერთ პაციენტში. ჩვილები განსაკუთრებით მგრძნობიარეები არიან K ვიტამინის მალაბსორციის მიმართ, რადგან მისი მხოლოდ უმნიშვნელო რაოდენობა გადის პლაცენტაში, რაც ბავშვს ვიტამინის მცირე რეზერვით ტოვებს. რადგან II, VII, IX, და X ფაქტორები (შედედების ფაქტორები) K ვიტამინდამოკიდებული ფაქტორებია, ვიტამინის მცირე რაოდენობა გამოიწვევს კოაგულაციის პრობლემებს. როდესაც ბავშვს აღენიშნება აუხსნელი წარმოშობის სისხლჩაქცევები, გამომწვევი დაავადების დასადგენად გამართლებულად შეიძლება ჩაითვალოს კოაგულაციის შეფასება.[15]
ფილტვები და ძვლოვანი წიაღები
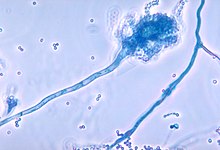

მწვანე = Pseudomonas aeruginosa
ყავისფერი = Staphylococcus aureus
ლურჯი = Haemophilus influenzae
წითელი =Burkholderia cepacia კომპლექსი
შესქელებული ლორწოს დაგროვება, ჰაერგამტარი გზების დახშობა და მათი გაწმენდის შემცირება იწვევს ინფექციების განვითარებას.[16][17] ანთებითი პროცესები იწვევს ფილტვის სტრუქტურულ დაზიანებას, სიმპტომები ვარიაბელურია. ადრეულ ეტაპებზე დამახასიათებელია შეუჩერებელი ხველა, ნახველის დიდი რაოდენობით წარმოქმნა და ვარჯიშის შემცირებული შესაძლებლობა. ამ სიმპტომების უმრავლესობა მჟღავნდება მაშინ, როდესაც ბაქტერია, რომელიც ჩვეულებრივ სახლდება შესქელებულ ლორწოზე, უკონტროლოდ მრავლდება და იწვევს პნევმონიას. გვიან სტადიაზე იცვლება ფილტვის არქიტექტურა, კერძოდ, ძირითადი ჰაერგამტარი გზების (ბრონქოექტაზი) რასაც მოჰყვება სუნთქვის გართულების გამწვავება. სხვა სიმპტომებია: სისხლის ამოხველება (ჰემოფტიზი), ფილტვში სისხლის მაღალი წნევა (პულმონარული ჰიპერტენზია, გულის უკმარისობა, ჟანგბადის მიღების გართულება (ჰიპოქსია) და რესპირატორული უკმარისობა რაც საჭიროებს ჟანგბადის ნიღბის გამოყენებას.[18] ინფექციის ყველაზე ხშირი გამომწვევები კისტური ფიბროზით დაავადებულებში არის Staphylococcus aureus, Haemophilus influenzae და Pseudomonas aeruginosa.[17] ტიპური ბაქტერიული ინფექციების გარდა CF პაციენტებს უვითრდებათ სხვა ტიპის ფილტვის დაავადებები. მათ შორისაა ბრონქოპულმონარული ასპერგილოზი, როდესაც ორგანიზმის საპასუხო რეაქცია სოკო Aspergillus fumigatus-ის მიმართ იწვევს სუნთქვის გართულებას. ინფექციის სხვა გამომწვევია Mycobacterium avium კომპლექსი (MAC), ბაქტერიების ჯგუფი, რომლებიც იწვევენ ტუბერკულოზს, ფილტვების მძიმე დაზიანებებს და არ პასუხობენ ძირითადი ანტიბიოტიკებით მკურნალობას.[19]
ლორწო პარანაზალურ სინუსებში ისევე სქელია, როგორც ჰაერგამტარ გზებში, შესაბამისად შეიძლება დაეხშოს სინუსების შესავალი რასაც მოჰყვება ინფექციის განვითარება. მდგომარეობას შეიძლება მოჰყვეს სახისა და თავის ტკივილი, ცხელება, გამონადენი ცხვირიდან. კისტური ფიბროზით დაავადებულ ინდივიდებს სინუსების ქრონიკული ანთების გამო შეიძლება განუვითარდეთ ცხვირის პოლიპები.[20] ცხვირის პოლიპები CF პასინტების 10-25%-ში ვითარდება.[17] პოლიპებმა შეიძლება დაახშოს ცხვირის გასავლები ქოანები და გამოიწვიოს სუნთქვის გაძნელება.[21][22]
კარდიორესპირაციული გართულებები სიკვდილის ყველაზე ხშირი მზეზია (≈80%) აშშ-ის CF ცენტრებში.[17]
კუჭ-ნაწლავი
ახალშობილებისა და ნაყოფის პრენატალური სკრინინგის დროს კისტური ფიბროზის დიაგნოზი ისმებოდა, როდესაც ნაყოფი ვერ გამოყოფდა მეკონიუმს (ნაყოფის განავალი). მეკონიუმმა შეიძლება მთლიანად დაახშოს ნაწლავები და გამოიწვიოს სერიოზული პრობლემები. მეკონიუმის გაუვალობა აქვს კისტური ფიბროზით დაავადებული ახალშობილების 5-10%-ს.[17][23] CF-ით დაავადებული ბავშვების 10%-ს უვითრდებათ სწორი ნაწლავის პროლაფსი (გარეთ გამოვარდნა),[17] რაც გამოწვეულია ფეკალიების დიდი რაოდენობით დაგროვებით, მალნუტრიციითა და გაზრდილი მუცლისღრუსშიდა წნევით (რაც თავის მხრივ გამოწვეულია ხშირი ხველებით).[24]
ფილტვებში ლორწოს შესქელებასთნ ერთად აღინიშნება პანკრეასის სეკრეტის შესქელებაც, სეკრეტის, რომელიც შეიცავს მომნელებელ ფერმენტებს. გამომდინარე იქიდან რომ შესქელებული სეკრეტი აღარ გადაადგილდება თორმეტგოჯა ნაწლავში, მომნელებელი ფერმენტები, რომლებიც მასშია აზიანებს თავად პანკრეასის ჯირკვალს (პანკრეატიტი).[25] შორსწასულ შემთხვევებში პანკრეასის სადინარები შეიძლება ბოლომდე იყოს დახშული, რაც ხშირად ხდება მოზრდილ ბავშვებსა და ზრდასრულებში.[17] ეს იწვევს ეგზოკრინული ჯირკვლის ატროფიასა და ფიბროზს.[17]
მომნელებელი ფერმენტების ნაკლებობის გამო არ ხდება ნივთიერებების ადეკვატური შეწოვა და შესაბამისად გამოიყოფა დიდი რაოდენობით დეფეკაციისას, მდგომარეობა, რომელსაც ეწოდება მალაბსორბცია. ნივთიერებების ნაკლებობის გამო ჩერდება ზრდისა და განვითარების პროცესი. შედეგად მიღებულმა ჰიპოპროტეინემიამ შეიძლება გამოიწვიოს გენერალიზებული შეშუპება.[17] CF-ით დაავადებულ ინდივიდებს აქვთ ცხიმში ხსნადი ვიტამინების A, D, K, E აბსორბციის პრობლემა.
პანკრეასის პრობლემებთან ერთად, კისტური ფიბროზით დაავადებულ ადამიანებს აქვთ ხშირი გულძმარვა, ნაწლავების ბლოკადა და ყაბზობა (გაუვალობა).[26] მოზრდილ ინდივიდებს შეიძლება განუვითრდეთ დისტალური ნაწლავის ობსტრუქციის სინდრომი, როდესაც შესქელებული განავალი ახშობს ნაწლავის სანათურს.[27]
კისტური ფიბროზით დაავადებული პაციენტების 85-90%-ში ვითარდება პანკრეასის ეგზოკრინული უკმარისობა.[17] მდგომარეობა ძირითდად გამოწვეულია CFTR გენში მომხდარი მუტაციით, (ΔF508/ΔF508, 508-ე პოზიციაში, ორივე ალელში დელეცირებულია ფენილალანინის მაკოდირებელი კოდონი).[17] პაციენტების 10-15%-ს აქვს ერთი ნორმალური და ერთი მუტანტური ალელი, ასეთ შემთხვევაში ცილის (CFTR) ფუნქცია ნაწილობრივ შენარჩუნებულია.[17] ასევე შენარჩუნებულია პანკრეასის ეგზოკრინული ფუნქციონირება და ფერმენტების ჩანაცვლებითი თერაპია არ არის საჭირო.[17] პანკრეასის შენარჩუნებული ფუნქციონირების ფენოტიპის მქონე ინდივიდებში არ აღინიშნება რაიმე სხვა გასტროინტესტინალური გართულებები, როგორც წესი, ასეთი პაციენტების ზრდა და განვითარება მიმდინარეობს ნორმალურად.[17] ზოგიერთ შემთხვევაში ქრონიკული იდიოპათიური პანკრეატიტი (მდგომარეობა, რომელიც ხასიათდება მუცლის მწვავე ტკივილით და სიცოცხლისთვის საშიში გართულებებით) შეიძლება განვითარდეს ინდივიდებში, რომელთა პანკრეასის ფუნქცია მეტნაკლებად შენარჩუნებულია.[17]
სეკრეტების გასქელებამ შეიძლება გამოიწვიოს ღვიძლის პრობლემებიც. ღვიძლის მიერ სინთეზირებული ნაღველი ახშობს ნაღვლის სადინრებს, რასაც მოჰყვება ღვიძლის პარენქიმის დაზიანება. დროთა განმავლობაში ვითარდება ციროზი. ღვიძლი ვეღარ ასრულებს თავის ფუნქციებს (სისხლში არსებული ტოქსინების დეტოქსიკაცია, მნიშვნელოვანი ცილების, მათ შორის, კოაგულაციის ფაქტორების სინთეზი).[28][29] კისტური ფიბროზით დაავადებულთა სიკვდილის მესამე ყველაზე ხშირი გამომწვევი ღვიძლის დაავადებებია.[17]
ენდოკრინული სისტემა
პანკრეასში არის ლანგერჰანსის კუნძულები, რომლებიც პასუხისმგებელია ინსულინის პროდუქციაზე. პანკრეასის დაზიანებას შეიძლება მოჰყვეს კუნძულის უჯრედების დაკარგვა, რაც გამოიწვევს დიაბეტის კისტური ფიბროზისთვის დამახასიათებელი ფორმის განვითარებას.[30] კისტურ ფიბროზთან დაკავშირებულ დიაბეტს აქვს დიაბეტი ტიპი 1-სა და დიაბეტი ტიპი 2-თან საერთო მახასიათბელი ნიშნები და არის CF-ის ერთ-ერთი ყველაზე ხშირი არაპულმონალური გართულება.[31] ვიტამინი D დაკავშირებულია კალციუმისა და ფოსფატების ცვლასთან. D ვიტამინის შეზღუდულმა მიღებამ დიეტით, მალაბსორბციის გამო შეიძლება გამოიწვიოს ძვლის დაავადებები, ოსტეოპოროზი, რომლის დროსაც ძვლების მოტეხილობების ალბათობა იზრდება.[32] ამასთანავე ჟანგბადის ნაკლებობისა და ქრონიკული ავადობის გამო კისტური ფიბროზით დაავადებულ ადამიანებს უვითარდებათ დოლის ჩხირების მაგვარი თითები.[33][34]
უშვილობა
უშვილობა ვლინდება როგორც მამაკაცებში ასევე ქალებში. კისტური ფიბროზით დაავადებული მამაკაცების 97% უნაყოფოა, მაგრამ არა სტერილური, ანუ მათ შეუძლიათ სპერმატოზოიდების პროდუქცია და შეიძლება ჰყავდეთ შვილები ხელოვნური განაყოფიერების მეთოდების გამოყენებით.[35] უნაყოფობის მიზეზი მამაკაცებში ძირითადად არის თესლის გამომტანი სადინრის განუვითარებლობა (სადინარი, რომელიც აკავშირებს სათესლეებს პენისის ეაკულატორულ ტრაქტთან), უნაყოფობა შეიძლება ასევე გამოიწვიოს სპერმის პროდუქციის დარღვევამ (ტერატოსპერმია)[36] იმ მამაკაცების ნაწილს, რომლებიც იყვნენ უშვილოები და არ ჰქონდათ თესლის გამომტანი სადინრები განვითარებული, აღმოაჩნდათ კისტური ფიბროზის მსუბუქი ფორმა.[37] კისტური ფიბროზით დაავადებული ქალების დაახლოებით 20%-ს აქვს უნაყოფობის პრობლემები საშვილოსნოს ყელის ლორწოს შესქელების გამო. მძიმე შემთხვევებში მალნუტრიცია იწვევს ოვულაციის დარღვევას და ამენორეას.[38]
გამომწვევი მიზეზები

კისტური ფიბროზის ტრანსმემბრანული გამტარობის მარეგულირებელ ცილაში (CFTR) მომხდარი მუტაცია იწვევს კისტურ ფიბროზს. ყველაზე ხშირი მუტაციაა ΔF508, (Δ აღნიშნავს დელეციას),[39] როდესაც დელეცირებულია სამი ნუკლეოტიდი, რომელიც კოდირებს ცილის 508 პოზიციაში ფენილალანინს. ეს მუტაცია ხდება დაავადების შემთხვევათა ორ მესამედში (66–70%[17]) მსოფლიოს მასშტაბით და 90%-ში ამერიკის შეერთებულ შტატებში; თუმცა არსებობს 1500-ზე მეტი მუტაცია რომელმაც შეიძლება გამოიწვიოს კისტური ფიბროზი.[40] მიუხედავად იმისა, რომ ნორმალური გენოტიპის მქონე ინდივიდებს აქვთ გენის ორი ასლი, მხოლოდ ერთიც საკმარისია კისტური ფიბროზის თავიდან ასაცილებლად. CF ვითარდება მაშინ, როდესაც არცერთი ალელი არ არის ფუნქციური, შესაბამისად, კისტური ფიბროზი ითვლება აუტოსომურ რეცესიულ დაავადებად.
CFTR გენი, რომელიც მდებარეობს მე-7 ქრომოსომის q31.2 ლოკუსში (q აღნიშნავს ქრომოსომის გრძელ მხარს) და არის 230,000 ფუძეთა წყვილის სიგრძის, კოდირებს 1,480 ამინომჟავის სიგრძის ცილას. უფრო კონკრეტული მდებარეობა არის მეშვიდე ქრომოსომის გრძელი მხრის 117,120,016 ფუძეთა წყვილიდან 117,308,718 ფუძეთა წყვილამდე, რეგიონი 3, ბენდი 1, სუბ-ბენდი 2 წარმოდგენილი, როგორც 7q31.2. სტრუქტურულად, CFTR არის ABC ტიპის გენი. გენის პროდუქტია ქლორის იონური არხი, რომელიც მნიშვნელოვანია ოფლის, მომნელებელი წვენებისა და ლორწოს წარმოქმნაში. ცილას აქვს ორი ATP-ჰიდროლიზური დომეინი, რაც ცილას აძლევს ატფ-დან ენერგიის მიღების საშუალებას. ის ასევე შეიცავს 6 ალფა სპირალისგან შემდგარ ორ დომეინს, რის საშუალებითაც ცილა ჩაშენებულია მემბრანაში. ცილის რეგულატორული ნაწილი აქტიურდება ფოსფორილირებით, ძირითადად ცამპ-დამოკიდებული პროტეინ კინაზით[18] ცილის კარბოქსილური ბოლო დაკავშირებულია ციტოჩონჩხთან PDZ დომეინით.[41]
ასევე იზრდება შემთხვევები, როდესაც გენეტიკური მოდიფიკატორები ცვლიან დაავადების სიხშირესა და სიმძიმეს. ერთ-ერთი მაგალითია მანოზა-დაკავშირებული ლექტინი (mannan-binding lectin), რომელიც დაკავშირებულია თანდაყოლილ იმუნიტეტთან და ხელს უწყობს მიკროორგანიზმების ფაგოციტოზს. პოლიმორფიზმი MBL-ის ორივე ან ერთ ალელში იწვევს ამ ცილის ცირკულაციაში შემცირებას და დაკავშირებულია ისევე როგორც ფილტვის დაავადებების რისკის სამჯერ გაზრდასთან, ასევე ქრონიკულ ბაქტერიულ ინფექციებთან.[17]
პათოფიზიოლოგია

CFTR გენში შეიძლება მოხდეს სხვადასხვა მუტაცია, რომლებიც გამოიწვევენ CFTR ცილის სხვადასხვა სახის დეფექტს, ზოგჯერ მძიმეს, ზოგჯერ მსუბუქს. ცილის ეს დეფექტები არის ასევე სამკურნალო საშუალებების სამიზნე, რომლებმაც შეიძლება აღადგინონ მისი ფუნქცია. CFTR ცილის 508-ე პოზიციიდან ფენილალანინის დაკარგვას მოჰყვებას ცილის დახვევის (ფოლდინგის) დარღვევა რის გამოც ის უბიქვიტინირდება და დაიშლება პროტეასომების მეშვეობით. სხვა მუტაციის შედეგად წარმოიქმნება ცილა, რომელიც მოკლეა რადგან პროდუქცია წყდება ნაადრევად ან არ იყენებს ენერგიას ნორმალურად და არ ატარებს ქლორს, იოდსა და თიოციანატს პლაზმურ მემბრანაში ადეკვატურად.[42] მუტაციების შედეგად შეიძლება CFTR-ის მხოლოდ მცირე ნაწილი პროდუცირდეს.[18]
ცილა, რომელიც ამ გენით სინთეზდება ჩაშენებულია ფილტვების, პანკრეასის, საოფლე ჯირკვლებისა და სხვა ეგზოკრინული ჯირკვლების უჯრედების პლაზმურ მემბრანაში. ცილა მოქმედებს, როგორც არხი აკავშირებს რა ციტოპლაზმას უჯრედშორის სითხესთან და უზრუნველყოფს ჰალოგენების მოძრაობას პლაზმურ მემბრანაში. საოფლე ჯირკვლების სადინრებში ის უზრუნველყოფს ქლორის გადაადგილებას სადინრიდან ციტოპლაზმაში. როდესაც CFTR ცილას არ შეუძლია იონების შეთვისება, ქლორი და თიოციანატი,[43] რომლებიც გამოთავისუფლდება საოფლე ჯირკვლის სადინრის ეპითელური უჯრედების მიერ, რჩება სადინარშივე და საბოლოოდ გამოიყოფა კანზე. ამასთანავე ჰიპოთიოციანატი (OSCN, რესპირატორული სისტემის ბაქტერიციდული აგენტი), ვერ წარმოიქმნება იმუნური სისტემის მიერ.[44][45] გამომდინარე იქიდან რომ ქლორს აქვს უარყოფითი მუხტი, ის ქმნის ელექტრული პოტენციალის ტრანსმემბრანულ სხვაობას, რაც კათიონებს იზიდავს უჯრედის შიგნით. ნატრიუმი არის ექსტრაუჯრედული სივრცის ძირითადი კათიონი. საოფლე ჯირკვლების სადინრებში ქლორის დიდი რაოდენობა აფერხებს ნატრიუმის რეზორბციას ეპითელიუმის ნატრიუმის არხების მიერ და საბოლოოდ ნატრიუმისა და ქლორის ურთიერთქმედებით იქმნება მარილი, რომელიც დიდი რაოდენობით გამოიყოფა ოფლთან ერთად კისტური ფიბროზით დაავადებულ ინდივიდებში. სწორედ ამ მექანიზმის საფუძველზე ტარდება ოფლის ანალიზი კისტური ფიბროზის დიაგნოზის დასასმელად.[18]
კისტური ფიბროზისას ყველაზე დიდი ზიანი ორგანიზმს ადგება ორგანოების მიერ შესქელებული სეკრეტის გამოყოფის შედეგად ვიწრო გასასვლელების დახშობით. ბლოკადა ხელს უწყობს ინფექციების განვითარებას ფილტვებში, პანკრეასის დაზიანებას მომნელებელი ფერმენტების დაგროვების გამო, გაუვალობის განვითარებას ნაწლავებში და ა. შ. არსებობს რამდენიმე თეორია იმის შესახებ თუ როგორ იწვევს ცილის დეფექტი მსგავს კლინიკურ მანიფესტაციებს. ყველაზე გავრცელებული თეორიის თანახმად იონების ტრანსპორტის დეფექტი იწვევს ჰაერგამტარი გზების ეპითელიუმის დეჰიდრატაციას და ლორწოს შესქელებას. CFTR აკონტროლებს არამარტო ქლორის მოძრაობას, არამედ ნატრიუმის არხის (ENac) აქტივობასაც, რომელიც პასუხისმგებელია ნატრიუმის ინტრაუჯრედულ ტრანსპორტზე. CFTR ნორმაში აინჰიბირებს ამ არხის აქტივობას და მისი დეფექტის შემთხვევაში ნატრიუმის იონები უკონტროლოდ იწყებენ უჯრედში შესვლას. ამ გაზრდილი ნაკადის გამო წყალიც დაიწყებს უჯრედის შიგნით შესვლას და ჰაერგამტარი გზის ზედაპირული სითხის სიბლანტე გაიზრდება (ნაკლები წყლის შემცველობის გამო).[46] რადგან ასეთ გარემოში წამწამების მოძრაობა შეზღუდულია და ვეღარ ასრულებენ თავიანთ გამწმენდ ფუნქციას, ზედაპირზე გროვდება დიდი რაოდენობით ლორწო.[47] საკვები ნივთიერებით მდიდარი ლორწო ხელს უწყობს ბაქტერიებს იმუნური სისტემისგან დამალვას, რაც განმეორებითი რესპირაციული ინფექციების მიზეზი ხდება. იგივე CFTR ცილა არსებობს პანკრეასისა და საოფლე ჯირკველბის უჯრედებში, რითაც აიხსნება ამ ლოკაციებში განვითარებული პათოლოგიური ცვლილებები.
ქრონიკული ინფექციები
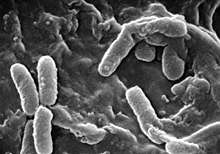

კისტური ფიბროზით დაავადებული ინდივიდების ფილტვებში ბაქტერიები ადრეულ ასაკშივე იწყებენ კოლონიების შექმნას გასქელებულ ლორწოზე, რომელიც გროვდება ჰაერგამტარ გზებში. ლორწო ქმნის ბაქტერიულ მიკროგარემოს, რომლებიც რთული მისაღწევია იმუნური სისტემის უჯრედებისა და ანტიბიოტიკებისთვის. შესქელებული ლორწოს სეკრეცია და ხშირი ინფექციები აზიანებს ფილტვებს ჰაერგამტარი გზების თანდათანობითი რემოდელირებით, რაც ინფექციის აღმოფხვრას უფრო ართულებს.[48]
დროთა განმავლობაში კისტური ფიბროზით დაავადებულ ინდივიდებში ბაქტერიების ტიპი და მათი მახასიათებელი ნიშნები იცვლება. საწყის ეტაპზე ფილტვის ინფიცირება ხდება ისეთი ბაქტერიებით როგორიცაა ოქროსფერი სტაფილოკოკი და Haemophilus influenzae.[17] საბოლოოდ დომინირებს Pseudomonas aeruginosa (და ზოგჯერ Burkholderia cepacia). 18 წლის ასაკისთვის პაციენტების 80% P. aeruginosa-ს სამიზნე ხდება, ხოლო 3.5%-ში B. cepacia-სი.[17] მას შემდეგ, რაც ბაქტერია ადაპტირდება გარემოში ის იძენს რეზისტენტობას ყველაზე ხშირად გამოყენებული ანტიბიოტიკებისადმი. ფსევდომონამ შეიძლება შეიძინოს მახასიათებლები, რომლის საშუალებითაც წარმოქმნის დიდ კოლონიებს, რაც იშვიათად გვხვდება ინდივიდებში, რომლებიც არ არაიან დაავადებული კისტური ფიბროზით[48]
ინფექციების გავრცელების ერთ-ერთი გზაა კისტური ფიბროზით დაავადებულ ინდივიდებს შორის გადაცემა.[49] კისტური ფიბროზით დაავადებული ინდივიდები ხშირად მონაწილეობდნენ საზაფხულო "CF ბანაკებში".[50][51] კლინიკებში, სადაც კისტური ფიბროზით დაავადებული ინდივიდები იყვნენ დაჯგუფებული, [52] არ სტერილიზდებოდა ყოველდღიური მოხმარების ნივთები,[53] რაც ხელს უწყობდა პაციენტებს შორის საშიში ბაქტერიების გადაცემას. შედეგად კისტური ფიბროზით დაავადებული ინდივიდები ახლა არიან იზოლირებული ერთმანეთისგან და მედპერსონალს აცვია ხელთათმანები და ფორმები პაციენტის გასინჯვისას, რათა შემცირდეს ვირულენტური ბაქტერიული შტამების გავრცელება.[54]
CF პაციენტების ჰაერგამტარი გზები ასევე შეიძლება იყოს კოლონიზებული ფილამენტური სოკოთი (როგორიცაა Aspergillus fumigatus, Scedosporium apiospermum, Aspergillus terreus) და/ან საფუარები (როგორიცაა Candida albicans); სხვა ფილამენტური სოკოებიდან იშვიათად გვხვდება Aspergillus flavus, Aspergillus nidulans, Exophiala dermatitidis და Scedosporium prolificans (ჰაერგამტარი გზების ქრონიკული კოლონიზატორი); ზოგიერთი სოკო როგორიცაა Penicillium emersonii და Acrophialophora fusispora ითვლება ექსკლუზიურ სახეობებად კისტური ფიბროზის თვალსაზრისით (გვხვდება იშვიათად).[55] დაქვეითებული მუკოცილიარული გაწმენდა, რაც მახასიათებელია კისტური ფიბროზის, დაკავშირებულია ლოკალურ იმუნოლოგიურ დარღვევებთან. ამასთანავე, გახანგძლივებულმა მკურნალობამ ანტიბიოტიკებით და კორტიკოსტეროიდების გამოყენებამ შეიძლება ასევე დაასტიმულიროს სოკოების ზრდა. მიუხედავად იმისა, რომ ჰაერგამტარი გზების სოკოებით კოლონიზაციით კლინიკური მნიშვნელობა კვლავაც განხილვის საგანია, მათ შეიძლება გამოიწვიონ ლოკალური ანთებითი პროცესები და ფილტვის ფუნქციების მწვავე გაუარესება, რაც ხშირად ხდება ალერგიული ბრონქო-პულმონალური ასპარგილოსისას (ABPA-ყველაზე ხშირი სოკოს მიერ გამოწვეული დაავადება კისტური ფიბროზით დაავადებულ ინდივიდებში), მოიცავს Th2-მიერ წარმართული იმუნური პასუხს ასპარგილუსის მიმართ.[55][56]
დიაგნოზი და მონიტორინგი

კისტური ფიბროზის დიაგნოზის დასმა სხვადასხვა გზით შეიძლება მათ შორისაა ახალშობილთა სკრინინგი, ოფლის ანალიზი, გენეტიკური ტესტირება.[57] 2006 წლის მონაცემებით, ამერიკის შეერთებულ შტატებში შემთხვევათა 10%-ში დიაგნოზი მალევე დაისვა ახალშობილთა სკრინინგის პროგრამით. ახალშობილების სკრინინგი ემყარება სისხლში იმუნორეაქტიული ტრიფსინოგენის მომატებული მაჩვენებლების აღმოჩენას.[58] ნორმიდან გადახრილი მაჩვენებლების შემთხვევაში კეთდება დამატებით ოფლის ანალიზი. ხშირ შემთხვევაში მშობელი ითხოვს ახალშობილის ტესტირებას რადგან ბავშვის კანი მარილიანია.[17] ტრიფსინოგენის დონე შეიძლება გაიზარდოს ინდივიდებში, რომელთაც აქვთ CFTR' გენის ერთი მუტანტური ასლი (ანუ არის დაავადების მატარებელი) ან იშვიათად ორივე ნორმალური ასლის მქონე ინდივიდებშიც. ახალშობილების სკრინინგი სადავო საკითხია სწორედ ამ ცრუ დადებითი პასხების გამო.[59][60] ქვეყნების უმეტესობა არ ატარებს ბავშების სკრინინგს კისტურ ფიბროზზე, მაშასადამე, ინდივიდების უმეტესობის დიაგნოზირება სიმპტომების გამოჩენის შემდეგ ხდება (მაგალითად: სინოპულმონარული დაავადებები და კუჭ-ნაწლავისმხრივი გამოვლინებები[17]). ყველაზე ხშირად გამოიყენება ოფლის ანალიზი. ოფლის ტესტირება გულისხმობს მისი პროდუქციის გაძლიერებას პრეპარატით (პილოკარპინი). პრეპარატი შეიყვანება კანიდან იონოფორეზით (ერთი ელექტროდი თავსდება პრეპარატიან მხარეზე და მეორე კანის თავისუფალ ნაწილზე). პროდუცირებული ოფლი შეგროვდბა ფილტრის ქაღალდზე ან კაპილარულ მილში და უტარდება ანალიზი ნატრიუმისა და ქლორის აბნორმალურ შემცველობაზე. კისტური ფიბროზით დაავადებულ ადამიანებს აქვთ მომატებული ნატრიუმისა და ქლორის კონცენტრაცია ოფლში, მაგრამ შემცირებული თიოციანატი და ჰიპოთიოციანატი ნერწყვსა და ლორწოში.[61] CF-ის დიანოზირება ხდება ასევე CFTR გენში მუტაციის აღმოჩენით.[62]
პრენატალური დიაგნოზი
წყვილებს, რომლებიც ელოდებიან ბავშვს ან დაგეგმილი აქვთ ორსულობა, შეუძლიათ ჩაიტარონ გენეტიკური კვლევა CFTR გენის მუტაციებზე, რათა განისაზღვროს კისტური ფიბროზით დაავადებული ბავშვის გაჩენის რისკი. გენეტიკური ტესტი ტიპურად უტარდება ორივე მშობელს, თუ კისტური ფიბროზის რისკი იქნება მაღალი ამ შემთხვევაში ტესტი უტარდება ნაყოფსაც. მეანობისა და გინეკოლოგიის ამერიკული კოლეჯის რეკომენდაციით გენეტიკური ტესტირება უნდა ჩაიტარონ მომავალმა მშობლებმა, რომელთაც ოჯახის ისტორიაში აქვთ კისტური ფიბროზის დიაგნოზი, ასევე მათი რეკომენდაციით ყველა კავკასიელმა წყვილმა უნდა ჩაიტაროს გენეტიკური ტესტირება კისტური ფიბროზის მატარებლობაზე. [63]
ნაყოფში კისტური ფიბროზის გამოვლენისთვის აუცილებელია მან ორივე მშობლისგან მიიღოს CFTR გენის მუტანტური ალელი, მაგრამ რადგან გენეტიკური ტესტი კისტურ ფიბროზზე ძვირია, ტესტირება საწყის ეტაპზე უტარდება ერთ მშობელს. თუ აღმოჩნდება რომ ეს მშობელი CFTR გენის მუტაციის მატარებელია, მაშინ ტესტირება უტარდება მეორე მშობელსაც კისტური ფიბროზით დაავადებული ბავშვის გაჩენის რისკის გამოსათვლელად. კისტური ფიბროზი შეიძლება გამოწვეული იყოს ათასობით სხვადასხვა მუტაციით, რაც შეუძლებელს ხდის ყველა მათგანის დეტექციას. ტესტი ტარდება ყველაზე ხშირი მუტაციის მიმართ (ΔF508) — კომერციულად ყველაზე ხელმისაწვდომია 32 ან ნაკლები მუტაციის ძებნა. თუ ცნობილია რომ ოჯახს აქვს იშვიათი მუტაცია, სკრინინგი ტარდება ამ მუტაციის მიმართ. გამომდინარე იქიდან რომ შეუძლებელია ყველა მუტაციის მიმართ სკრინინგის ჩატარება, ტესტის უარყოფითი პასუხი არ ნიშნავს, რომ ბავშვს არ ექნება კისტური ფიბროზი.[64]
ორსულობისას ტესტირება შეიძლება გაკეთდეს პლაცენტაზე (ქორიონული ხაოს კვლევა) ან ამნიონურ სითხეში არსებულ უჯრედებზე (ამნიოცენტეზი). თუმცა, ქორიუნული ხაოდან მასალის აღებას აქვს ნაყოფის დაღუპვის რისკი (1:100) და ამნიოცენტეზს 1:200;[65] ახალი კვლევებით ეს მაჩვენებელი შეიძლება იყოს ბევრად მცირე, დაახლოებით 1:1 600.[66]
მართვა
მიუხედავად იმისა რომ ჯერ არ არსებობს კისტური ფიბროზისგან საბოლოოდ განკურნების ხერხები არსებობს გარკვეული მკურნალობის მეთოდები. კისტური ფიბროზის მენეჯმენტი ბოლო 70 წლის განმავლობაში განვითარდა. 70 წლის წინ კისტური ფიბროზით დაავადებული ბავშვები უმეტესად ცოცხლობდნენ 1 წლამდე, დღესდღეობით ამ დაავადებით დაავადებულ ბაშვებს შეუძლიათ იცოცხლონ ზრდასრულ ასაკამდე. უახლესი მიღწევების საშუალებით შესაძლებელია პაციენტების მეტნაკლებად სრულფასოვანი ცხოვრობით უზრუნველყოფა, გართულებების გარეშე (ეს ძირითადად შეეხება განვითარებულ ქვეყნებს). დაავადების მართვის მთავარი ასპექტებია სასუნთქი გზების ინფექციების მკურნალობა, კარგი კვება და აქტიური ცხოვრების წესი. პულმონარული რეაბილიტაცია, როგორც კისტური ფიბროზის მენეჯმენტი გრძელდება ადამიანის სიცოცხლესთან ერთად და მიზანმიმართულია ორგანოს ფუნქციის მაქსიმალურად შენარჩუნებასა და შესაბამისად ცხოვრების ხარისხის გაუმჯობესებისკენ. საუკეთესო მკურნალობის პირობებში შესაძლებელია ფილტვის და სხვა ორგანოების ფუნქციების დიდხანს შენარჩუნება. გამომდინარე იქიდან, რომ დაავადება ხასიათდება სიმპტომების დიდი ვარიაციით, პაციენტები მკურნალობენ მულტიდისციპლინარული ცენტრების სპეციალისტებთან. მკურნალობა მორგებულია ინდივიდზე. თერაპიის სამიზნე ორგანოებია ფილტვები, საჭმლის მომნელებელი ტრაქტი (რაც მოიცავს პანკრეასული ფერმენტების დამატებასაც) და რეპროდუქციული ორგანოები.[58]
კისტური ფიბროზის მკურნალობაში ყველაზე მნიშვნელოვანი ასპექტია ფილტვების დაზიანების შემცირება და შესქელებული ლორწოს მიერ გამოწვეული ინფექციების მკურნალობა სიცოცხლის ხარისხის შესანარჩუნებლად. ინტრავენური, ორალური და საინჰალაციო, ანტიბიოტიკები გამოიყენება ქრონიკული ინფექციების სამკურნალოდ. მექანიკური მოწყობილობებისა და ინჰალაციური თერაპიის მიზანია შესქელებული ლორწოს გათხელება. თერაპიის ეს საშუალებები ეფექტიანი თუმცა საჭიროებს დიდ დროს, რაც პაციენტისტვის დამთრგუნველია.
ანტიბიოტიკები
კისტური ფიბროზით დაავადებული ადამიანებს პერმანენტულად მკურნალობენ ერთი ან მეტი ანტიბიოტიკით. ანტიბიოტიკები არის აუცილებლად საჭიროა როდესაც ვიტარდება პნევმონია ან ფილტვის ფუნქცია მნიშვნელოვნად ქვეითდება. ანტიბიოტიკის ირჩევენ ნახველის ანალიზის საფუძველზე. ეს ხანგრძლივი თერაპია ხშირად საჭიროებს ჰოსპიტალიზაციას და პერიფერიული ან ცენტრალური ვენის კათეტერიზაციას. ტობრამიცინით, ქოლისტინით, და აზტრეონამით ინჰალაცია ხანდახან ინიშნება თვიურად, მანამდე სანამ არ გაუმჯობესდება ფილტვის ფუნქცია ბაქტერიების კოლონიის ზრდის შეფერხების ხარჯზე.[67][68][69] ანტიბიოტიკების ინჰალაციური თერაპია აუმჯობესებს ფილტვის ფუნქციას, მაგრამ ამასთანავე აქვს გვერდითი ეფექტებიც როგორიცაა ანტიბიოტიკორეზისტენტობის განვითარება და ხმის ცვლილება[70] ორალური ანტიბიოტიკები: ციპროფლოქსაცინი ან აზიტრომიცინი ეძევათ პაციენტებს ინფექციის თავიდან ასაცილელად ან მიმდინარე ინფექციის კონტროლისთვის.[71] ამინოგლიკოზიდების (მაგალითად ტობრამიცინი) ხანგრძლივად გამოყენებამ შეიძლება გამოიწვიოს სმენის დაკარგვა, წონასწორობის სისტემის დაზიანება შიგნითა ყურში, ან თირკმლის პრობლემები.[72] ამ გვერდითი ეფექტების თავიდან ასაცილებლად რუტინულად უნდა შემოწმდეს სისხლში ანტიბიოტიკების კონცენტრაცია.
ფილტვის დაავადებების ალტერნატიული მკურნალობის ხერხები
არსებობს სხვადასხვა ტექნიკები სასუნთქი გზებიდან ნახველის მექანიკურად მოცილებისთვის. კლინიკებში გამოიყენება, გულმკერდის ფიზიოთერაპია (CPT); მოწყობილობები, რომლებიც ქმნიან პერკუსიულ (დარტყმით) თერაპიას არის: ThAIRapy Vest და ინტრაპულმონარული პერკუსიული ვენტილატორი (IPV). უფრო ახალი მეთოდები ბიფაზური აბჯრისმიერი ვენტილაცია ეხმარება სეკრეტირებული შესქელებული ლორწოს მოცილებაში და ჰაერგამტარი გზების გაწმენდაში. აპარატი არის მოსახერხებელი სახლის პირობებში გამოყენებისთვის.[73]
ივაკაფტორი არის ორალურად მისაღები პრეპარატი კისტური ფიბროზის გარჯვეული მუტაციების შემთხვევაში დაავადების სამკურნალოდ.[74][75] ის ზრდის ფილტვის ფუნქციას 10%-ით, პრეპარატი საკმაოდ ძვირადღირებულია.[74]
შესაძლებელია სეკრეტის გამათხიერებელი პრეპარატების აეროზოლის სახით მიწოდება, ასეთებია დორნაზე ალფა და ჰიპერტონიული ხსნარი.[76] დორნაზე არის ადამიანის რეკომბინანტული დეოქსირიბონუკლეაზა, რომელიც შლის დნმ-ს ლორწოში და ამცირებს მის ვისკოზურობას.[77] დენუფოზოლი არის საკვლევი პრეპარატი, რომელიც ხსნის ქლორის ალტერნატიულ არხებს, რაც ხელს უწყობს ლორწოს გათხიერებას.[78] ბოლომდე გაურკვეველია კორტიკოსტეროიდების ინჰალაციის ეფექტი.[79]
ფილტვის დაავადების გაუარესებისას საჭირო ხდება ხელოვნური ვენტილაციის ჩარევა. კისტური ფიბროზით დაავადებულ ინდივიდებს შეიძლება დასჭირდეთ ღამით სპეციალური ნიღბების ტარება, რაც დაეხმარებათ სუნთქვაში. ეს აპარატი ცნობილია, როგორც ჰაერგამტარი გზების პოზიტიური წნევის (BiPAP) ორდონიანი ვენტილატორი. ის უზრუნველყოფს ძილისას სისხლში ჟანგბადის ნორმალური დონის შენარჩუნებას. BiPAP-ს გამოყენება შეიძლება ფიზიკური თერაპიის დროსაც ნახველისგან გასათავისუფლებლად.[80] უკიდურესი ფორმებისას შეიძლება გახდეს საჭირო სასუნთქ გზებში ხელოვნური მილის ჩადგმა, ან ტრაქეოსტომის გაკეთება.
კვლევებმა აჩვენა, რომ ბავშვებში მასაჟით თერაპიას შეიძლება ჰქონდეს დადებითი ეფექტები და გააუმჯობესოს ოჯახების ცხოვრების ხარისხი.[81] გაურკვეველია რა ეფექტი აქვს პნევმოკოკზე ვაქცინაციას, რადგან კვლევები არ გაგრძელებულა 2014 წლის შემდეგ.[82]
ტრანსპლანტაცია
ფილტვის ტრანსპლანტაცია ხშირად ხდება საჭირო კისტური ფიბროზით დაავადებული ინდივიდებისთვის. ერთი ფილტვის ტრანსპლანტაცია შესაძლებელია სხვა დაავადებების შემთხვევაში, მაგრამ კისტური ფიბროზისას უნდა მოხდეს ორივე ფილტვის ტრანსპლანტაცია, რადგან ხელუხლებელ ფილტვში შეიძლება იყოს დარჩენილი ბაქტერიის კულტურა, რომელიც შემდგომ დააინფიცირებს ტრანსპლანტირებულ ფილტვსაც. პაციენტებს შეიძლება ამავდროულად გადაუნერგონ პანკრეასი ან ღვიძლი დიაბეტის ან ღვიძლის პრობლემების თავიდან ასაცილებლად.[83] ფილტვის გადანერგვა ნაჩვენებია მაშინ, როდესაც მისი ფუნქცია უკიდურესად მცირდება და აუცილებელია ხელოვნური ვენტილაცია.[84]
სხვა ასპექტები

ახალშობილებს, რომლებსაც აქვთ ინტესტინალური ობსტრუქცია ტიპურად საჭიროებენ ოპერაციულ ჩარევას მაშინ, როდესაც ზრდასრულებს დისტალური ინტესტინალური ობსტრუქციის სინდრომით არ ესაჭიროებათ ეს პროცედურა. პანკრეასული ფერმენტების ჩანაცვლებითი თერაპიით თორმეტგოჯა ნაწლავში ადეკვატურად მოხდება ნივთიერებების დაშლა და შეწოვა. თერაპიის გარეშე ეს ნივთიერებები დაიკარგებოდა ნარჩენებთან ერთად. ჯერჯერობით არაა დაზუსტებული პანკრეასული ფერმენტების მიღების ზუსტი დოზა, ასევე უცნობია მკურნალობის ხანგრძლივი ეფექტები და რისკები.[85]
აქამდე არ ჩატარებულა ფართომასშტაბიანი კვლევა კისტური ფიბროზით დაავადებულ ზრდასრულ ინდივიდებში ათეროსკლეროზისა და კორონარული არტერიული დაავადების განვითარებას შორის კავშირზე. ეს ძირითადად იმის შედეგია რომ კისტური ფიბროზით დაავადებული ინდივიდები არ ცოცხლობენ იმდენ ხანს, რომ გამოუვლინდეთ კლინიკურად მნიშვნელოვანი ათეროსკლეროზი ან კორონალური არტერიების დაავადება.
კისტური ფიბროზის ერთ-ერთი მნიშვნელოვანი არაფილტვისმიერი გართულებაა დიაბეტი. მასში გაერთიანებულია შაქრიანი დიაბეტი ტიპი 1-სა და ტიპი 2-ის ნიშნები, რის გამოც განიხილება ცალკე, როგორც კისტურ ფიბროზთან დაკავშირებული დიაბეტი(CFRD).[31][86] მიუხედავად იმისა, რომ ზოგჯერ გამოიყენება ანტიდიაბეტური პრეპარატები, ერთადერთი რეკომენდირებული მკურნალობა არის ინსულინის ინექციები ან ინსულინის პამპი.[87] დიაბეტის 1 და 2 ტიპისგან განსხვავებით დიეტური შეზღუდვები არ არის რეკომენდირებული.[31]
ოსტეოპოროზის განვითარების თავიდან აცილება შესალებელია ვიტამინი D-ს და კალციუმის დამატებით. მკურნალობა შესაძლებელია ბისფოსფონატებით, თუმცა გვერდითი ეფექტები შეიძლება გახდეს პრობლემა.[88] ზრდაში შეფერხებსგან თავის დაცვა შეიძლება კალორიებით მდიდარი საკვების მიწოდებით ან ზრდის ჰორმონის ინექციით.[89]
ძვლოვანი წიაღების (პარანაზალური წიაღბი) ინფექციებისას პაციენტებს უტარდებათ ხანგრძლივი ანტიბიოტიკოთერაპია. ცხვირის პოლიპების განვითარებამ ან ცხვირის გასავლების ქრონიკულმა ცვლილებებმა შეიძლება უკიდურესად შეამციროს ჰაერის გასვლა და სუნის შეგრძნება. წიაღების ოპერაციას ხშირად მიმართავენ ცხვირის სავალების ობსტრუქციის კორექციისთვის და ინფექციების შემდგომი გავრცელების თავიდან ასარიდებლად. ცხვირის სტეროიდები, როგორიცაა ფლუტიკაზონი გამოიყენება ცხვირის ლორწოვანის ანთებების შესამცირებლად.[90]
ქალებში უნაყოფობის პრობლემის გადაჭრა შესაძლებელია in vitro განაყოფიერების ტექნიკით, კერძოდ ნაყოფის გადატანის ტექნიკით. კაცებში უნაყოფობა ძირითადად გამოწვეულია თესლის გამომტანი სადინრის გამუვითარებლობით და ამ პრობლემის გადაჭრა შესაძლებელია ტესტიკულარული სპერმის გამოქოფით (TESE), რაც გულისხმობ სპერმის შეგროვებას უშუალოდ სათესლეებიდან. თუ შეგროვებული მასალა შეიცავს სპონტანური განაყოფიერებისთვის არასაკმარის სპერმატოზოიდებს შეიძლება ჩატარდეს სპერმის ინტრაციტოპლაზმური ინექცია[91] გაურკვეველია ანტიოქსიდანტების მიღების ეფექტი უნაყოფობაზე[92]
პროგნოზი
კისტური ფიბროზის პროგნოზი გაუმჯობესდა ადრეული დიაგნოსტიკით, უკეთესი მკურნალობითა და ჯანდაცვის ხელმისაწვდომობით. 1959 წელს კისტური ფიბროზით დაავადებული ბავშვების სიცოცხლის საშუალო ხანგძლივობა იყო 6 თვე.[93] 2010 წელს ქალებისთვის ეს მაჩვენებელი 37 წელს ხოლო კაცებისთვის 40 წელს შეადგენს.[94] კანადაში 1982-2007 წლის ფარგლებში სიცოცხლის საშუალო ხანგრძლივობა 24 წლიდან 47 წლამდე გაიზარდა[95]
იმ ინდივიდების 92%, რომლებიც არიან 18 წელზე ზევით ირიცხებოდნენ უმაღლეს სასწავლებლებში (2009 წლის მონაცემებით), 67%-ს ჰქონდა კოლეჯის განათლება, 15% იყო უნარშეზღუდული, 9% უმუშევარი, 56% დაუოჯახებელი, 39% დაქორწინებული, ან ცხოვრობდა პარტნიორთან ერთად.[96]
ცხოვრების ხარისხი
ქრონიკული დაავადება შეიძლება იყოს ძალიან რთული სამართავი. კისტური ფიბროზი არის ქრონიკული დაავადება, რომელიც აზიანებს საჭმლის მომნელებელ და რესპირატორულ ტრაქტს, რაც თავის მხირვ იწვევს გენერალიზებულ მალნუტრიციასა და ქრონიკულ რესპირაციულ ინფექციებს.[97] სქელი სეკრეტი ახშობს ჰაერგამტარ გზებს, რასაც ხშირ შემთხვევაში მოჰყვება ფილტვებში ანთებითი პროცესების განვითრება.[98][99] მდგომარეობამ შეიძლება გავლენა მოახდინოს ცხოვრების ხარისხზე და მათ შესაძლბლობებზე შეასრულონ ყოველდღიური ქმედებები. კისტური ფიბროზით დაავადებული პაციენტებისთვის მნიშვნელვანია ქრონიკული დაავადებისა და ცხოვრების ხარისხის უერთიერთკავშირის გააზრება. შმიტცისა და გოლდბექის მიხედვით (2006) კისტური ფიბროზი მნიშვნელოვნად ზრდის ემოციურ სტრესს, როგორც პაციენტში ასევე მის ოჯახის წევრებში, და ყოველდღიურმა დროის დამხარჯველმა მკურნალობის განრიგმა შეიძლება იქონიოს კიდევ უფრო უარყოფითი გავლენა ცხოვრების ხარისხზე.[100] ჰავერმანსმა და მისმა კოლეგებმა (2006) აჩვენეს, რომ ახალგაზრდა ამბულატორიულ პაციენტებს, რომლებიც მონაწილეობენ გამოკითხვაში ჰქონდათ უფრო მაღალი ცხოვრების ხარისხის მაჩვენებელი ვიდრე მათ მშობლებს.[101] ამასთანავე, კისტური ფიბროზის ამბულატორიულ პაციენტებს ჰქონდათ პოზიტიური შეხედულებები თავიანთ თავზე. არსებობს ბევრი გზა კისტური ფიბროზით დაავადებული ინდივიდებიც ცხოვრების ხარისხის გასაუმჯობესებლად. ვარჯიში ზრდის ფილტვების ფუნქციურ აქტივობას და ვარჯიშის შეთავსებამ მკურნალობის ყოველდღიურ პროცედურებთან შეიძლება შესამჩნევად გააუმჯობესოს პაციენტის ცხოვრების ხარისხი.[102] ჯერჯერობით არ არსებობს კისტური ფიბროზისგან განკურნების გზები, თუმცა არსებობს პრეპარატები, როგორიცაა მუკოლიტიკები, ბრონქოდილატატორები, სტეროიდები და ანტიბიოტიკები, რომლებიც გამოიყენება ლორწოს გასათხიერებლად, ჰაერგამტარი გზების გასაფართოვებლად, ანთებითი პროცესების ჩასაცხრობად და ფილტვის ინფექციების წინააღმდეგ საბრძოლველად.[103]
ეპიდემიოლოგია
| მუტაცია | სიხშირე მსოფლიოს მასშტაბით[104] |
|---|---|
| ΔF508 | 66%–70%[17] |
| G542X | 2.4% |
| G551D | 1.6% |
| N1303K | 1.3% |
| W1282X | 1.2% |
| სხვა დანარჩენი | 27.5% |
კისტური ფიბროზი არის ყველაზე ხშირი აუტოსომურ-რეცესიული დაავადება ევროპელ ხალხში.[105] ამერიკის შეერთებულ შტატებში დაახლოებით 30,000 ინდივიდს აქვს კისტური ფიბროზი; უმეტესობას დიაგნოზი 6 თვის ასაკში ესმება. კანადაში დაახლოებით 4,000 ადამიანია დაავადებული კისტური ფიბროზით.[106] დაახლოებით 25 დან 1 ევროპული წარმოშობის ადამიანებში და 30-დან 1 კავკასიელ ამერიკელებში[107] არიან კისტური ფიბროზის მუტაციის მატარებლები. მიუხედავად იმისა, რომ კისტური ფიბროზი ნაკლებად ხშირი დაავადებაა ესპანურენოვან ქეყნებში დაახლოებით 46-დან 1 ატარებს ორიდან ერთ ნორმალურ ალელს, აფრიკელებში ეს მაჩვენებელია 1:65 ხოლო აზიელებში 1:90[108][109] კისტური ფიბროზი ყველაზე ხშირია ირლანდიაში (1:1353).[110]
მიუხედავად იმისა რომ კისტური ფიბროზი იშვიათი დაავადებაა, მაინც ითვლება ყველაზე ფართოდ გავრცელებულ სიცოცხლის ხანგრძლივობის შემამცირებელ დაავადებად. ის ყველაზე ხშირია დასავლეთ მსოფლიოს ქვეყნებში. გამონაკლისია ფინეთი, სადაც მხოლოდ 80 ადამიანი ატარებს CFTR გენში მუტაციას.[111] ჯანდაცვის მსოფლიო ორგანიზაციის ცნობით ევროკავშირში 2000–3000 ახალშობილიდან 1 არის დაავადებული კისტური ფიბროზით.[112] აშშ-ში 3,500 დან 1 იბადება ამ დაავადებით.[113] 1997 წელს, დაახლოებით 3,300 კავკასიელი ბავშვიდან 1 დაიბადა კისტური ფიბროზით აშშ-ში.[114]
კისტურ ფიბროზი ერთნაირად გავრცელებულია მამაკაცებსა და ქალებში. მონაცემებზე დაყრდნობით კისტური ფიბროზით დაავადებული მამაკაცები უფრო დიდხანს ცოცხლობენ ვიდრე ქალები.[115][116] უახლესი კვლევების თანახმად ჯანდაცვის განვითარებამ შეიძლება აღმოფხვრას ეს სქესობრივი განსხვავება,[117][118] მაშინ, როდესაც ირლანდიაში მიმდინარე კვლევებით დადგინდა გარკვეული კავშირი ქალის ჰორმონ ესტროგენსა და კისტური ფიბროზის კლინიკური გამოვლინების დამძიმებას შორის.[119]
CF ალელების გავრცელება ვარირებს პოპულაციებს შორის. ΔF508 ფენოტიპის მატარებელ ინდივიდთა სიხშირეა1:200 ჩრდილოეთ შვედეთში, 1:143 ლიტვაში და 1:38 დანიაში არცერთი ΔF508 მატარებელი არ აღმოჩნდა 171 ფინელსა და 151 საამს შორის.[120] ΔF508 მუტაცია არსებობს ფინეთში, თუმცა ის აქ ძალიან დაბალი სიხშირითაა. კისტური ფიბროზი ფინეთში მხოლოდ 20 საგვარტომოშია დაფიქსირებული.[121]
ევოლუცია
- ქოლერა: ქოლერას ტოქსინი საჭიროებს ნორმალურ CFTR ცილას ფუნქციონირებისთვის. წამოყენებულია ჰიპოთეზა, რომ მუტანტური CFTR გენის მქონე ინდივიდები არიან რეზისტენტულები ქოლერისა და დიარეის გამომწვევი სხვა ბაქტერიების მოქმედების მიმართ,[122] ბოლომდე არ არის გამყარებული კვლევებით.[123][124]
- ტიფი: Salmonella Typhi ასევე საჭიროებს ნორმალურ CFTR ცილას უჯრედში მოსახვედრად,[125] რაც გულისხმობს, რომ ამ ცილის პათოლოგიური ვარიანტის მატარებლები დაცულები არიან ტიფისგან. არცერთ vivo კვლევას არ დაუდასტურებია ეს ფაქტი. აუხსნელი რჩება ასევე ის ფაქტი, რომ ევროპის გარეთ სადაც ტიფი და ქოლერა ენდემური დაავადებებია, ნაკლებადაა გავრცელებული კისტური ფიბროზი.
- დიარეა: წამოყენებულია ჰიპოთეზა, რომ ევროპაში კისტური ფიბროზის მაღალი მაჩვენებელი დაკავშირებულია რქოსანი პირუტყვის მოშინაურებასან. ან ჰიპოთეზის თანახმად CFTR გენის მუტაციის მატარებელი ინდივიდები დაცული არიან დიარეისგან, რომელიც გამოწვეულია ლაქტოზას აუტანლობით.[126]
- ტუბერკულოზი: მუტანტური გენის მატარებლებს შეიძლება ჰქონდეთ გარკვეული რეზისტენტობა ტუბერკულოზის მიმართ.[127][128]
ისტორია

ფიქრობენ, რომ კისტური ფიბროზი გამოჩნდა დაახლოებით ძვ. წ. 3 000 წელს, რაც მიგრაციების, გენის მუტაციის და კვების თავისებურებების ცვლილებით იყო გამოწვეული.[129] კისტური ფიბროზის მთლიანი კლინიკური სპექტრი არ იყო ცნობილი ჯერ კიდევ 1930 წლამდე, მაგრამ გარკვეული ასპექტები უფრო ადრეც გამოირკვა. მე-18 საუკუნის გერმანულ და შვეიცარიულ ლიტერატურაში იკითხება გაფრთხილება: „იდარდეთ ბავშვზე, რომელსაც შუბლზე კოცნისას მარილის გეო აქვს, ის დაწყელილია და მალე მოკვდება“ (Wehe dem Kind, das beim Kuß auf die Stirn salzig schmeckt, er ist verhext und muss bald sterben), სადაც კარგად ჩანს კავშირი მარილის კარგვასა და დაავადებას შორის.[129]
მე-19 საუკუნეში, კარლ ფონ როკიტანსკიმ აღწერა ნაყოფის სიკვდილის შემთხვევა მეკონიუმის პერიტონიტით (მეკონიუმის გაუვალობის გართულებული ფორმა კისტური ფიბროზის დროს). მეკონიუმის გაუვალობა პირველად 1905 წელს აღწერა კარლ ლანდშტაინერმა.[129] 1936 წელს, გვიდო ფანკონიმ გამოაქვეყნა ნაშრომი სადაც აღწერილი იყო კავშირი ცელიაკიას, პანკრეასულ კისტურ ფიბროზსა და ბრონქოექტაზს შორის[130]
1938 წელს დოროთი ჰანსინ ანდერსენმა გამოაქვეყნა სტატია „პანკრეასული კისტური ფიბროზი და მისი კავშირი ცელიაკიასთან: კლინიკური და პათოლოგიური კვლევა,“ ბავშვთა დაავადებების ამერიკულ ჟურნალში. ის იყო პირველი ვინც აღწერა პანკრეასული კისტური ფიბროზის მახასიათებლები და დააკავშირა ფილტვისა და ნაწლავების დაავადებებთან.[7] მან ასევე პირველმა გამოთქვა მოსაზრება რომ კისტური ფიბროზი არის აუტოსომუტ-რეცესიული დაავადება და პირველმა გამოიყენა პანკრეასის ფერმენტების ჩანაცვლებითი თერაპია დაავადებული ბავშვების განსაკურნებლად. 1952 წელს პოლ დი სანტ აგნესმა აღმოაჩინა დარღვევები ოფლის ელექტროლიტურ შემადგენლობაში. ოფლის ტესტი განვითარდა და დაიხვეწა შემდეგ ათწლეულში.[131]
პირველი კავშირი კისტურ ფიბროზსა და სხვა მარკერებს (პარაოქსონაზები-ორგანოფოსფატების ჰიდროლიზში მონაწილე ფერმენტების ჯგუფი) შორის გააკეთა ჰანს ეიბერგმა 1985 წელს. მან მიუთითა, რომ მხოლოდ 1 ლოკუსი არსებობს კისტური ფიბროზისთვის. 1988 წელს აღმოაჩინეს პირველი მუტაცია ΔF508 მე-7 ქრომოსომაზე, ფრანსის კოლინსმა, ლაპ-ჩე ცუიმ და ჯონ რ. რიორდანმა. შემდგომმა კვლევებმა გამოავლინა 1 000 სხვა მუტაცია, რომელიც იწვევს კისტურ ფიბროზს.
გამომდინარე იქიდან რომ CFTR გენში მომხდარი მუტაციები მცირე ზომისაა კლასიკური გენეტიკური ტესტირებებით ვერ მოხერხდა მუტირებული გენის ზუსტი დეტექცია.[132] ცილის მარკერების გამოყენებამ შესაძლებელი გახადა მე-7 ქრომოსომაში მუტაციის აღმოჩენა.[133] 1989 წელს ლაპ-ჩე ცუიმ დაავადებულ ბავშვთა ჰოსპიტალის (ტორონტო) მკვლევართა ჯგუფის ლიდერმა შეძლო კისტურ ფიბროზზე პასუხისმგებელი გენის გამოვლენა.
კვლევა
გენური თერაპია
გენური თერაპია არის კისტური ფიბროზისგან განკურნების პოტენციური გზა. CFTR გენის თერაპიაზე ჩატარებული კვლევის შედეგები არ იძლევა მისი, როგორც სამკურნალო საშუალების გამოყენების გარანტიას, რადგან ეს კვლევები არ იყო კლინიკური მნიშვნელობის.[134]

თეორიულად, გენური თერაპიით ხდება მუტანტური CFTR გენის ჩანაცვლება ნორმალური ასლით. დაზიანებულ ეპითელიუმში ნორმალური CFTR-ის გენის ჩასმა განაპირობებს ამ უჯრედების მიერ ფუნქციური CFTR ცილის სინთეზს გვერდითი ეფექტებისა და ანთებითი რეაქციების გარეშე. კვლევებმა აჩვენა, რომ კისტური ფიბროზის ფილტვისმხრივი მანიფესტაციის თავიდან ასაცილებლად საკმარისია CFTR გენის ნორმალური ექსპრესიის მხოლოდ 5-10%.[135] მრავალი მიღწევაა გენის უჯრედებში გადატანაში, როგორიცაა ლიპოსომები და ვირუსული ვექტორები, თუმცა ორივე მეთოდი ჯერჯერობით არაეფექტიანია.[136] ძირითადი მიზეზი არის ის რომ უჯრედთა მხოლოდ მცირე ნაწილი ითვისებს ვექტორებს და ექსპრესირებს გენს ამიტომაც მკურნალობას აქვს მცირე ეფექტი. ამასთანავე პრობლემები შეიქმნა cDNA-თან მიმართებაში (კომპლემენტარული დნმ), გენი რომელიც გამოიყენებოდა მკურნალობისთვის უფუნქციო აღმოჩნდა.[137] კისტური ფიბროზით დაავადებული პაციენტების ნაწლავების ღეროვან უჯრედებში შეასწორეს CFTR გენი, CRISPR/Cas9-ის (გენის ჩამატების ტექნიკა) გამოყენებით. [138]
მცირე მოლეკულები
ჯერ კიდევ ვითარდება მცირე მოლეკულები, რომლებსაც შეუძლიათ CFTR გენში მომხდარი მუტაციების კომპენსირება. ერთ-ერთი მიღწევაა პრეპარატი, რომლის მოქმედებითაც რიბოსომა ტოვებს სტოპ-კოდონს და საბოლოოდ სინთეზდება ნორმალური ზომის CFTR ცილა. კისტური ფიბროზის 10% გამოწვეულია ნონსენს მუტაციით. წამლების ეს ჯგუფი მოქმედებს ისეთ ნონსენს მუტაციებზე, როგორებიცაა G542X (როდესაც 542-ე პოზიციაში ამინომჟავა გლიცინი ჩანაცვლებულია სტოპ-კოდონით). ამინოგლიკოზიდები-ანტიბიოტიკები მოქმედებენ ცილის სინთეზზე და შეცდომების გასწორებაზე. ზოგიერთ შემთხვევაში მათი საშუალებით შეიძლება ცილის სინთეზის ნაადრევი დასრულების თავიდან აცილება, რაც საბოლოოდ სრული ზომის ცილის სინთეზს უზრუნველყოფს მცირე ცვლილებით.[139] ამინოგლიკოზიდი გენტამიცინი გამოიყენაბა ფილტვის უჯრედებზე კისტური ფიბროზის სამკურნალოდ.[140] სხვა წამალი რომელიც ნონსენს მუტაციის მაკორეგირებელია არის ატალურენი, რომელიც გადის კვლევის მესამე ფაზას 2011 წლის ოქტომბრიდან.[141]
სქოლიო
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 1.8 O'Sullivan, BP; Freedman, SD (30 May 2009). „Cystic fibrosis“. Lancet. 373 (9678): 1891–904. doi:10.1016/s0140-6736(09)60327-5. ISSN 0140-6736. PMID 19403164.
- ↑ 2.0 2.1 2.2 Bush, [edited by] Margaret Hodson, Duncan Geddes, Andrew (2012) Cystic fibrosis, 3rd ed., London: Hodder Arnold, გვ. 3. ISBN 9781444113693.
- ↑ 3.0 3.1 3.2 Massie, J; Delatycki, MB (December 2013). „Cystic fibrosis carrier screening“. Paediatric respiratory reviews. 14 (4): 270–5. doi:10.1016/j.prrv.2012.12.002. PMID 23466339.
- ↑ Buckingham, Lela (2012) Molecular diagnostics fundamentals, methods, and clinical applications, 2nd ed., Philadelphia: F.A. Davis Co., გვ. 351. ISBN 9780803629752.
- ↑ Yankaskas JR, Marshall BC, Sufian B, Simon RH, Rodman D (2004). „Cystic fibrosis adult care consensus conference report“. Chest. 125 (90010): 1–39. doi:10.1378/chest.125.1_suppl.1S. PMID 14734689.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)[მკვდარი ბმული]
- ↑ Davies, JC; Ebdon, AM; Orchard, C (November 2014). „Recent advances in the management of cystic fibrosis“. Archives of Disease in Childhood. 99 (11): 1033–6. doi:10.1136/archdischild-2013-304400. PMID 24996790.
- ↑ 7.0 7.1 Andersen DH (1938). „Cystic fibrosis of the pancreas and its relation to celiac disease: a clinical and pathological study“. Am J Dis Child. 56: 344–399. doi:10.1001/archpedi.1938.01980140114013.
- ↑ Quinton PM (June 2007). „Cystic fibrosis: lessons from the sweat gland“. Physiology (Bethesda). 22 (3): 212–25. doi:10.1152/physiol.00041.2006. PMID 17557942. დაარქივებულია ორიგინალიდან — 2013-04-15. ციტირების თარიღი: 2015-06-22.
- ↑ 9.0 9.1 Hardin DS (August 2004). „GH improves growth and clinical status in children with cystic fibrosis – a review of published studies“. Eur. J. Endocrinol. 151 (Suppl 1): S81–5. doi:10.1530/eje.0.151S081. PMID 15339250.
- ↑ 10.0 10.1 De Lisle RC (September 2009). „Pass the bicarb: the importance of HCO3- for mucin release“. J. Clin. Invest. 119 (9): 2535–7. doi:10.1172/JCI40598. PMC 2735941. PMID 19726878.
- ↑ O'Malley CA (May 2009). „Infection control in cystic fibrosis: cohorting, cross-contamination, and the respiratory therapist“ (PDF). Respir Care. 54 (5): 641–57. doi:10.4187/aarc0446. PMID 19393108. დაარქივებულია ორიგინალიდან (PDF) — 15.07.2011. ციტირების თარიღი: 22.06.2015. შეამოწმეთ თარიღის პარამეტრი
|accessdate=და|archivedate=-ში (დახმარება) - ↑ Makker K, Agarwal A, Sharma R (April 2009). „Oxidative stress & male infertility“ (PDF). Indian J. Med. Res. 129 (4): 357–67. PMID 19535829. დაარქივებულია ორიგინალიდან (PDF) — 2010-07-05. ციტირების თარიღი: 2015-06-22.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Blackman SM, Deering-Brose R, McWilliams R, Naughton K, Coleman B, Lai T, Algire M, Beck S, Hoover-Fong J, Hamosh A, Fallin MD, West K, Arking DE, Chakravarti A, Cutler DJ, Cutting GR (October 2006). „Relative contribution of genetic and nongenetic modifiers to intestinal obstruction in cystic fibrosis“. Gastroenterology. 131 (4): 1030–9. doi:10.1053/j.gastro.2006.07.016. PMC 1764617. PMID 17030173.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Ratjen FA (May 2009). „Cystic fibrosis: pathogenesis and future treatment strategies“ (PDF). Respir Care. 54 (5): 595–605. doi:10.4187/aarc0427. PMID 19393104. დაარქივებულია ორიგინალიდან (PDF) — 15.07.2011. ციტირების თარიღი: 22.06.2015. შეამოწმეთ თარიღის პარამეტრი
|accessdate=და|archivedate=-ში (დახმარება) - ↑ Reaves J, Wallace G (2010). „Unexplained bruising: weighing the pros and cons of possible causes“. Consultant for Pediatricians. 9: 201–2.
- ↑ Flume PA, Mogayzel Jr PJ, Robinson KA; et al. (March 2010). „Cystic Fibrosis Pulmonary Guidelines: Pulmonary Complications: Hemoptysis and Pneumothorax“. Am J Respir Crit Care Med. 182 (3): 298–306. doi:10.1164/rccm.201002-0157OC. PMID 20299528. et al.-ის დაწვრილებითი გამოყენება
|author=-ში (დახმარება)CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link) - ↑ 17.00 17.01 17.02 17.03 17.04 17.05 17.06 17.07 17.08 17.09 17.10 17.11 17.12 17.13 17.14 17.15 17.16 17.17 17.18 17.19 17.20 17.21 17.22 Mitchell, Richard Sheppard; Kumar, Vinay; Robbins, Stanley L.; Abbas, Abul K.; Fausto, Nelson (2007). Robbins basic pathology. Saunders/Elsevier. ISBN 1-4160-2973-7.
- ↑ 18.0 18.1 18.2 18.3 Rowe SM, Miller S, Sorscher EJ (May 2005). „Cystic fibrosis“. The New England Journal of Medicine. 352 (19): 1992–2001. doi:10.1056/NEJMra043184. PMID 15888700.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Girón RM, Domingo D, Buendía B, Antón E, Ruiz-Velasco LM, Ancochea J (October 2005). „Nontuberculous mycobacteria in patients with cystic fibrosis“. Arch. Bronconeumol. (Spanish). 41 (10): 560–5. doi:10.1016/S1579-2129(06)60283-8. PMID 16266669.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)[მკვდარი ბმული]
- ↑ Franco LP, Camargos PA, Becker HM, Guimarães RE (December 2009). „Nasal endoscopic evaluation of children and adolescents with cystic fibrosis“. Braz J Otorhinolaryngol. 75 (6): 806–13. doi:10.1590/S1808-86942009000600006. PMID 20209279.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Maldonado M, Martínez A, Alobid I, Mullol J (December 2004). „The antrochoanal polyp“. Rhinology. 42 (4): 178–82. PMID 15626248.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Ramsey B, Richardson MA (September 1992). „Impact of sinusitis in cystic fibrosis“. J. Allergy Clin. Immunol. 90 (3 Pt 2): 547–52. doi:10.1016/0091-6749(92)90183-3. PMID 1527348.
- ↑ Eggermont E, De Boeck K (October 1991). „Small-intestinal abnormalities in cystic fibrosis patients“. Eur. J. Pediatr. 150 (12): 824–8. doi:10.1007/BF01954999. PMID 1743211.
- ↑ Kulczycki LL, Shwachman H (August 1958). „Studies in cystic fibrosis of the pancreas; occurrence of rectal prolapse“. N. Engl. J. Med. 259 (9): 409–12. doi:10.1056/NEJM195808282590901. PMID 13578072.
- ↑ Cohn JA, Friedman KJ, Noone PG, Knowles MR, Silverman LM, Jowell PS (September 1998). „Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis“. N. Engl. J. Med. 339 (10): 653–8. doi:10.1056/NEJM199809033391002. PMID 9725922.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Malfroot A, Dab I (November 1991). „New insights on gastro-esophageal reflux in cystic fibrosis by longitudinal follow up“. Arch. Dis. Child. 66 (11): 1339–45. doi:10.1136/adc.66.11.1339. PMC 1793275. PMID 1755649.
- ↑ Khoshoo V, Udall JN (February 1994). „Meconium ileus equivalent in children and adults“. Am. J. Gastroenterol. 89 (2): 153–7. PMID 8304294.
- ↑ Williams SG, Westaby D, Tanner MS, Mowat AP (October 1992). „Liver and biliary problems in cystic fibrosis“. Br. Med. Bull. 48 (4): 877–92. PMID 1458306.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Colombo C, Russo MC, Zazzeron L, Romano G (July 2006). „Liver disease in cystic fibrosis“. J. Pediatr. Gastroenterol. Nutr. 43 (Suppl 1): S49–55. doi:10.1097/01.mpg.0000226390.02355.52. PMID 16819402.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Moran A, Pyzdrowski KL, Weinreb J, Kahn BB, Smith SA, Adams KS, Seaquist ER (August 1994). „Insulin sensitivity in cystic fibrosis“. Diabetes. 43 (8): 1020–6. doi:10.2337/diabetes.43.8.1020. PMID 8039595.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ 31.0 31.1 31.2 Alves Cde A, Aguiar RA, Alves AC, Santana MA (April 2007). „Diabetes mellitus in patients with cystic fibrosis“. J Bras Pneumol. 33 (2): 213–21. doi:10.1590/S1806-37132007000200017. PMID 17724542.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Haworth CS, Selby PL, Webb AK, Dodd ME, Musson H, McL Niven R, Economou G, Horrocks AW, Freemont AJ, Mawer EB, Adams JE (November 1999). „Low bone mineral density in adults with cystic fibrosis“. Thorax. 54 (11): 961–7. doi:10.1136/thx.54.11.961. PMC 1745400. PMID 10525552.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Vandemergel X, Decaux G (April 2003). „[Review on hypertrophic osteoarthropathy and digital clubbing]“. Revue Médicale de Bruxelles (French). 24 (2): 88–94. PMID 12806875.
- ↑ Pitts-Tucker TJ, Miller MG, Littlewood JM (June 1986). „Finger clubbing in cystic fibrosis“. Arch. Dis. Child. 61 (6): 576–9. doi:10.1136/adc.61.6.576. PMC 1777828. PMID 3488032.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ McCallum TJ, Milunsky JM, Cunningham DL, Harris DH, Maher TA, Oates RD (October 2000). „Fertility in men with cystic fibrosis: an update on current surgical practices and outcomes“. Chest. 118 (4): 1059–62. doi:10.1378/chest.118.4.1059. PMID 11035677.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Chen H, Ruan YC, Xu WM, Chen J, Chan HC (2012). „Regulation of male fertility by CFTR and implications in male infertility“. Human Reproduction Update. 18 (6): 703–713. doi:10.1093/humupd/dms027. PMID 22709980.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Augarten A, Yahav Y, Kerem BS, Halle D, Laufer J, Szeinberg A, Dor J, Mashiach S, Gazit E, Madgar I (November 1994). „Congenital bilateral absence of vas deferens in the absence of cystic fibrosis“. Lancet. 344 (8935): 1473–4. doi:10.1016/S0140-6736(94)90292-5. PMID 7968122.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Gilljam M, Antoniou M, Shin J, Dupuis A, Corey M, Tullis DE (July 2000). „Pregnancy in cystic fibrosis. Fetal and maternal outcome“. Chest. 118 (1): 85–91. doi:10.1378/chest.118.1.85. PMID 10893364.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Profile : Lap-Chee Tsui. Science.ca (1989-05-09). ციტირების თარიღი: 2013-01-23.
- ↑ Bobadilla JL, Macek M, Fine JP, Farrell PM (June 2002). „Cystic fibrosis: a worldwide analysis of CFTR mutations—correlation with incidence data and application to screening“. Hum. Mutat. 19 (6): 575–606. doi:10.1002/humu.10041. PMID 12007216.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Short DB, Trotter KW, Reczek D, Kreda SM, Bretscher A, Boucher RC, Stutts MJ, Milgram SL (July 1998). „An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton“. J. Biol. Chem. 273 (31): 19797–801. doi:10.1074/jbc.273.31.19797. PMID 9677412.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Childers, Eckel და Himmel 2007
- ↑ Xu, Szép და Lu 2009
- ↑ Moskwa, Lorentzen და Excoffon 2007
- ↑ Conner, Wijkstrom-Frei და Randell 2007
- ↑ Verkman AS, Song Y, Thiagarajah JR.
- ↑ Marieb & Hoehn, (2014) Human Antomy and Physiology, Chapter 22: The Respiratory System, pg 906, Pearson Education
- ↑ 48.0 48.1 Saiman L (2004). „Microbiology of early CF lung disease“. Paediatric Respiratory Reviews. 5 (Suppl A): S367–69. doi:10.1016/S1526-0542(04)90065-6. PMID 14980298.
- ↑ Tümmler B, Koopmann U, Grothues D, Weissbrodt H, Steinkamp G, von der Hardt H (June 1991). „Nosocomial acquisition of Pseudomonas aeruginosa by cystic fibrosis patients“. J. Clin. Microbiol. 29 (6): 1265–7. Bibcode:1991JPoSA..29.1265A. doi:10.1002/pola.1991.080290905. PMC 271975. PMID 1907611.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ „Pseudomonas cepacia at summer camps for persons with cystic fibrosis“. MMWR Morb. Mortal. Wkly. Rep. 42 (23): 456–9. June 1993. PMID 7684813.
- ↑ Pegues DA, Carson LA, Tablan OC, FitzSimmons SC, Roman SB, Miller JM, Jarvis WR (May 1994). „Acquisition of Pseudomonas cepacia at summer camps for patients with cystic fibrosis. Summer Camp Study Group“. J. Pediatr. 124 (5 Pt 1): 694–702. doi:10.1016/S0022-3476(05)81357-5. PMID 7513755.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Pankhurst CL, Philpott-Howard J (April 1996). „The environmental risk factors associated with medical and dental equipment in the transmission of Burkholderia (Pseudomonas) cepacia in cystic fibrosis patients“. J. Hosp. Infect. 32 (4): 249–55. doi:10.1016/S0195-6701(96)90035-3. PMID 8744509.
- ↑ Jones AM, Govan JR, Doherty CJ, Dodd ME, Isalska BJ, Stanbridge TN, Webb AK (June 2003). „Identification of airborne dissemination of epidemic multiresistant strains of Pseudomonas aeruginosa at a CF centre during a cross infection outbreak“. Thorax. 58 (6): 525–27. doi:10.1136/thorax.58.6.525. PMC 1746694. PMID 12775867.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Høiby N (June 1995). „Isolation and treatment of cystic fibrosis patients with lung infections caused by Pseudomonas (Burkholderia) cepacia and multiresistant Pseudomonas aeruginosa“. Neth J Med. 46 (6): 280–87. doi:10.1016/0300-2977(95)00020-N. PMID 7643943.
- ↑ 55.0 55.1 Pihet M, Carrere J, Cimon B, Chabasse D, Delhaes L, Symoens F, Bouchara JP (June 2009). „Occurrence and relevance of filamentous fungi in respiratory secretions of patients with cystic fibrosis—a review“. Med Mycol. 47 (4): 387–97. doi:10.1080/13693780802609604. PMID 19107638.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Rapaka RR, Kolls JK (2009). „Pathogenesis of allergic bronchopulmonary aspergillosis in cystic fibrosis: current understanding and future directions“. Med Mycol. 47 (Suppl 1): S331–7. doi:10.1080/13693780802266777. PMID 18668399.
- ↑ Mishra A, Greaves R, Massie J (November 2005). „The relevance of sweat testing for the diagnosis of cystic fibrosis in the genomic era“. The Clinical biochemist. Reviews / Australian Association of Clinical Biochemists. 26 (4): 135–53. PMC 1320177. PMID 16648884.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ 58.0 58.1 Davies JC, Alton EW, Bush A (December 2007). „Cystic fibrosis“. BMJ. 335 (7632): 1255–9. doi:10.1136/bmj.39391.713229.AD. PMC 2137053. PMID 18079549.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Ross LF (September 2008). „Newborn screening for cystic fibrosis: a lesson in public health disparities“. The Journal of Pediatrics. 153 (3): 308–13. doi:10.1016/j.jpeds.2008.04.061. PMC 2569148. PMID 18718257.
- ↑ Assael BM, Castellani C, Ocampo MB, Iansa P, Callegaro A, Valsecchi MG (September 2002). „Epidemiology and survival analysis of cystic fibrosis in an area of intense neonatal screening over 30 years“. American Journal of Epidemiology. 156 (5): 397–401. doi:10.1093/aje/kwf064. PMID 12196308.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Minarowski, Sands და Minarowska 2008
- ↑ Stern RC (February 1997). „The diagnosis of cystic fibrosis“. N. Engl. J. Med. 336 (7): 487–91. doi:10.1056/NEJM199702133360707. PMID 9017943.
- ↑ (2001) Preconception and prenatal carrier screening for cystic fibrosis. Clinical and laboratory guidelines. Washington DC: American College of Obstetricians and Gynecologists. ISBN 0915473747.
- ↑ Elias S, Annas GJ, Simpson JL (April 1991). „Carrier screening for cystic fibrosis: implications for obstetric and gynecologic practice“. Am. J. Obstet. Gynecol. 164 (4): 1077–83. doi:10.1016/0002-9378(91)90589-j. PMID 2014829.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Tabor A, Philip J, Madsen M, Bang J, Obel EB, Nørgaard-Pedersen B (June 1986). „Randomised controlled trial of genetic amniocentesis in 4606 low-risk women“. Lancet. 1 (8493): 1287–93. doi:10.1016/S0140-6736(86)91218-3. PMID 2423826.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Eddleman KA, Malone FD, Sullivan L, Dukes K, Berkowitz RL, Kharbutli Y, Porter TF, Luthy DA, Comstock CH, Saade GR, Klugman S, Dugoff L, Craigo SD, Timor-Tritsch IE, Carr SR, Wolfe HM, D'Alton ME (November 2006). „Pregnancy loss rates after midtrimester amniocentesis“. Obstet Gynecol. 108 (5): 1067–72. doi:10.1097/01.AOG.0000240135.13594.07. PMID 17077226.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Pai VB, Nahata MC (October 2001). „Efficacy and safety of aerosolized tobramycin in cystic fibrosis“. Pediatr. Pulmonol. 32 (4): 314–27. doi:10.1002/ppul.1125. PMID 11568993.
- ↑ Westerman EM, Le Brun PP, Touw DJ, Frijlink HW, Heijerman HG (March 2004). „Effect of nebulized colistin sulphate and colistin sulphomethate on lung function in patients with cystic fibrosis: a pilot study“. J. Cyst. Fibros. 3 (1): 23–8. doi:10.1016/j.jcf.2003.12.005. PMID 15463883.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ McCoy KS, Quittner AL, Oermann CM, Gibson RL, Retsch-Bogart GZ, Montgomery AB (November 2008). „Inhaled aztreonam lysine for chronic airway Pseudomonas aeruginosa in cystic fibrosis“. Am. J. Respir. Crit. Care Med. 178 (9): 921–8. doi:10.1164/rccm.200712-1804OC. PMC 2577727. PMID 18658109.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Ryan G, Singh M, Dwan K (2011). „Inhaled antibiotics for long-term therapy in cystic fibrosis“. The Cochrane Database of Systematic Reviews (3): CD001021. doi:10.1002/14651858.CD001021.pub2. PMID 21412868.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Hansen CR, Pressler T, Koch C, Høiby N (March 2005). „Long-term azitromycin treatment of cystic fibrosis patients with chronic Pseudomonas aeruginosa infection; an observational cohort study“. J. Cyst. Fibros. 4 (1): 35–40. doi:10.1016/j.jcf.2004.09.001. PMID 15752679.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Tan KH, Mulheran M, Knox AJ, Smyth AR (March 2003). „Aminoglycoside prescribing and surveillance in cystic fibrosis“. Am. J. Respir. Crit. Care Med. 167 (6): 819–23. doi:10.1164/rccm.200109-012CC. PMID 12623858.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ van der Schans C, Prasad A, Main E (2000). Van Der Schans, Cees P (ed.). „Chest physiotherapy compared to no chest physiotherapy for cystic fibrosis“. Cochrane Database Syst Rev (2): CD001401. doi:10.1002/14651858.CD001401. PMID 10796781.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ 74.0 74.1 Whiting, P; Al, M; Burgers, L; Westwood, M; Ryder, S; Hoogendoorn, M; Armstrong, N; Allen, A; Severens, H; Kleijnen, J (March 2014). „Ivacaftor for the treatment of patients with cystic fibrosis and the G551D mutation: a systematic review and cost-effectiveness analysis“. Health technology assessment (Winchester, England). 18 (18): 1–106. PMID 24656117.
- ↑ Wainwright, CE (October 2014). „Ivacaftor for patients with cystic fibrosis“. Expert review of respiratory medicine. 8 (5): 533–8. PMID 25148205.
- ↑ Kuver R, Lee SP (April 2006). „Hypertonic saline for cystic fibrosis“. N. Engl. J. Med. 354 (17): 1848–51, author reply 1848–51. doi:10.1056/NEJMc060351. PMID 16642591.
- ↑ Lieberman J (July 1968). „Dornase aerosol effect on sputum viscosity in cases of cystic fibrosis“. JAMA. 205 (5): 312–3. doi:10.1001/jama.205.5.312. PMID 5694947.
- ↑ Kellerman D, Rossi Mospan A, Engels J, Schaberg A, Gorden J, Smiley L (2008). „Denufosol: a review of studies with inhaled P2Y(2) agonists that led to Phase 3“. Pulmonary Pharmacology & Therapeutics. 21 (4): 600–7. doi:10.1016/j.pupt.2007.12.003. PMID 18276176.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Balfour-Lynn, IM; Welch, K (Oct 9, 2014). „Inhaled corticosteroids for cystic fibrosis“. The Cochrane database of systematic reviews. 10: CD001915. doi:10.1002/14651858.CD001915.pub4. PMID 25300165.
- ↑ Moran F, Bradley JM, Piper AJ (2009). Moran, Fidelma (ed.). „Non-invasive ventilation for cystic fibrosis“. Cochrane Database Syst Rev (1): CD002769. doi:10.1002/14651858.CD002769.pub3. PMID 19160211.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Huth MM, Zink KA, Van Horn NR (2005). „The effects of massage therapy in improving outcomes for youth with cystic fibrosis: an evidence review“. Pediatr Nurs. 31 (4): 328–32. PMID 16229132.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Burgess, L; Southern, KW (Aug 5, 2014). „Pneumococcal vaccines for cystic fibrosis“. The Cochrane database of systematic reviews. 8: CD008865. doi:10.1002/14651858.CD008865.pub3. PMID 25093421.
- ↑ Fridell JA, Vianna R, Kwo PY, Howenstine M, Sannuti A, Molleston JP, Pescovitz MD, Tector AJ (October 2005). „Simultaneous liver and pancreas transplantation in patients with cystic fibrosis“. Transplant. Proc. 37 (8): 3567–9. doi:10.1016/j.transproceed.2005.09.091. PMID 16298663.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Belkin RA, Henig NR, Singer LG, Chaparro C, Rubenstein RC, Xie SX, Yee JY, Kotloff RM, Lipson DA, Bunin GR (March 2006). „Risk factors for death of patients with cystic fibrosis awaiting lung transplantation“. Am. J. Respir. Crit. Care Med. 173 (6): 659–66. doi:10.1164/rccm.200410-1369OC. PMC 2662949. PMID 16387803.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Somaraju, UR; Solis-Moya, A (Oct 13, 2014). „Pancreatic enzyme replacement therapy for people with cystic fibrosis“. The Cochrane database of systematic reviews. 10: CD008227. doi:10.1002/14651858.CD008227.pub2. PMID 25310479.
- ↑ Zirbes J, Milla CE (September 2009). „Cystic fibrosis related diabetes“. Paediatr Respir Rev. 10 (3): 118–23, quiz 123. doi:10.1016/j.prrv.2009.04.004. PMID 19651382.
- ↑ Onady GM, Stolfi A (2005). Onady, Gary M (ed.). „Insulin and oral agents for managing cystic fibrosis-related diabetes“. Cochrane Database Syst Rev (3): CD004730. doi:10.1002/14651858.CD004730.pub2. PMID 16034943.
- ↑ Conwell LS, Chang AB (2012). Conwell, Louise S (ed.). „Bisphosphonates for osteoporosis in people with cystic fibrosis“. Cochrane Database Syst Rev. 4 (4): CD002010. doi:10.1002/14651858.CD002010.pub3. PMID 22513903.
- ↑ Hardin DS, Rice J, Ahn C, Ferkol T, Howenstine M, Spears S, Prestidge C, Seilheimer DK, Shepherd R (March 2005). „Growth hormone treatment enhances nutrition and growth in children with cystic fibrosis receiving enteral nutrition“. J. Pediatr. 146 (3): 324–8. doi:10.1016/j.jpeds.2004.10.037. PMID 15756212.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Marks SC, Kissner DG (1997). „Management of sinusitis in adult cystic fibrosis“. Am J Rhinol. 11 (1): 11–4. doi:10.2500/105065897781446810. PMID 9065342.
- ↑ Phillipson GT, Petrucco OM, Matthews CD (February 2000). „Congenital bilateral absence of the vas deferens, cystic fibrosis mutation analysis and intracytoplasmic sperm injection“. Hum. Reprod. 15 (2): 431–5. doi:10.1093/humrep/15.2.431. PMID 10655317.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Ciofu, O; Lykkesfeldt, J (Aug 7, 2014). „Antioxidant supplementation for lung disease in cystic fibrosis“. The Cochrane database of systematic reviews. 8: CD007020. doi:10.1002/14651858.CD007020.pub3. PMID 25102015.
- ↑ What is the life expectancy for people who have CF (in the United States)?. Cystic Fibrosis Foundation (2008). დაარქივებულია ორიგინალიდან — 2006-10-25. ციტირების თარიღი: 2010-03-14.
- ↑ MacKenzie, T; Gifford, AH; Sabadosa, KA; Quinton, HB; Knapp, EA; Goss, CH; Marshall, BC (Aug 19, 2014). „Longevity of patients with cystic fibrosis in 2000 to 2010 and beyond: survival analysis of the cystic fibrosis foundation patient registry“. Annals of internal medicine. 161 (4): 233–41. doi:10.7326/m13-0636. PMID 25133359.
- ↑ Canadian Cystic Fibrosis Patient Data Registry Report (PDF). Canadian Cystic Fibrosis Foundation (2007). დაარქივებულია ორიგინალიდან — 2010-07-15. ციტირების თარიღი: 2010-03-14.
- ↑ Cystic Fibrosis Patient Registry Annual Data Report 2009 (PDF). Cystic Fibrosis Foundation (2009). დაარქივებულია ორიგინალიდან — 2012-01-05. ციტირების თარიღი: 2015-06-22.
- ↑ Yu H, Nasr SZ, Deretic V (April 2000). „Innate lung defenses and compromised Pseudomonas aeruginosa clearance in the malnourished mouse model of respiratory infections in cystic fibrosis“. Infect. Immun. 68 (4): 2142–7. doi:10.1128/IAI.68.4.2142-2147.2000. PMC 97396. PMID 10722612.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)[მკვდარი ბმული]
- ↑ Ratjen F, Döring G (February 2003). „Cystic fibrosis“. Lancet. 361 (9358): 681–9. doi:10.1016/S0140-6736(03)12567-6. PMID 12606185.
- ↑ Rosenstein BJ, Zeitlin PL (January 1998). „Cystic fibrosis“. Lancet. 351 (9098): 277–82. doi:10.1016/S0140-6736(97)09174-5. PMID 9457113.
- ↑ Schmitz TG, Goldbeck L (2006). „The effect of inpatient rehabilitation programmes on quality of life in patients with cystic fibrosis: a multi-center study“. Health Qual Life Outcomes. 4: 8. doi:10.1186/1477-7525-4-8. PMC 1373610. PMID 16457728.
- ↑ Hegarty M, Macdonald J, Watter P, Wilson C (July 2009). „Quality of life in young people with cystic fibrosis: effects of hospitalization, age and gender, and differences in parent/child perceptions“. Child Care Health Dev. 35 (4): 462–8. doi:10.1111/j.1365-2214.2008.00900.x. PMID 18991968.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Moorcroft AJ, Dodd ME, Webb AK (1998). „Exercise limitations and training for patients with cystic fibrosis“. Disabil Rehabil. 20 (6–7): 247–53. doi:10.3109/09638289809166735. PMID 9637933.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Medications. Cystic Fibrosis Canada (2011). დაარქივებულია ორიგინალიდან — 2011-09-04. ციტირების თარიღი: 2015-06-22.
- ↑ Araújo FG, Novaes FC, Santos NP, Martins VC, Souza SM, Santos SE, Ribeiro-dos-Santos AK (January 2005). „Prevalence of deltaF508, G551D, G542X, and R553X mutations among cystic fibrosis patients in the North of Brazil“. Braz. J. Med. Biol. Res. 38 (1): 11–5. doi:10.1590/S0100-879X2005000100003. PMID 15665983.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Tobias, Edward (2011). Essential Medical Genetics. John Wiley & Sons, გვ. 312. ISBN 1-118-29370-3.
- ↑ The Canadian Facts & Figures on Cystic Fibrosis. დაარქივებულია ორიგინალიდან — 2013-06-16. ციტირების თარიღი: 2015-06-22.
- ↑ Genetic Carrier Testing. Cystic Fibrosis Foundation (2007). დაარქივებულია ორიგინალიდან — 2010-03-23. ციტირების თარიღი: 2015-06-22.
- ↑ Rosenstein BJ, Cutting GR (April 1998). „The diagnosis of cystic fibrosis: a consensus statement. Cystic Fibrosis Foundation Consensus Panel“. J. Pediatr. 132 (4): 589–95. doi:10.1016/S0022-3476(98)70344-0. PMID 9580754.
- ↑ Hamosh A, FitzSimmons SC, Macek M, Knowles MR, Rosenstein BJ, Cutting GR (February 1998). „Comparison of the clinical manifestations of cystic fibrosis in black and white patients“. J. Pediatr. 132 (2): 255–9. doi:10.1016/S0022-3476(98)70441-X. PMID 9506637.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Farrell P, Joffe S, Foley L, Canny GJ, Mayne P, Rosenberg M (September 2007). „Diagnosis of cystic fibrosis in the Republic of Ireland: epidemiology and costs“. Ir Med J. 100 (8): 557–60. PMID 17955689. დაარქივებულია ორიგინალიდან — 2013-12-03. ციტირების თარიღი: 2015-06-22.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Hytönen M, Patjas M, Vento SI, Kauppi P, Malmberg H, Ylikoski J, Kere J (December 2001). „Cystic fibrosis gene mutations deltaF508 and 394delTT in patients with chronic sinusitis in Finland“. Acta Otolaryngol. 121 (8): 945–7. doi:10.1080/000164801317166835. PMID 11813900.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ WHO | Genes and human disease. Who.int (2010-12-07). ციტირების თარიღი: 2013-01-23.
- ↑ Russell, Peter (2011). Biology : the dynamic science., 2nd, Belmont, CA: Brooks/Cole, Cengage Learning, გვ. 304. ISBN 978-0-538-49372-7.
- ↑ Genetic testing for cystic fibrosis Genetic Testing for Cystic Fibrosis. Consensus Development Conference Statement. National Institutes of Health (April 14–16, 1997). დაარქივებულია ორიგინალიდან — 2009-03-27. ციტირების თარიღი: 2015-06-22.
- ↑ Rosenfeld M, Davis R, FitzSimmons S, Pepe M, Ramsey B (May 1997). „Gender gap in cystic fibrosis mortality“. Am. J. Epidemiol. 145 (9): 794–803. doi:10.1093/oxfordjournals.aje.a009172. PMID 9143209.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Coakley RD, Sun H, Clunes LA, Rasmussen JE, Stackhouse JR, Okada SF, Fricks I, Young SL, Tarran R (December 2008). „17beta-Estradiol inhibits Ca2+-dependent homeostasis of airway surface liquid volume in human cystic fibrosis airway epithelia“. J. Clin. Invest. 118 (12): 4025–35. doi:10.1172/JCI33893. PMC 2582929. PMID 19033671.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Verma N, Bush A, Buchdahl R (October 2005). „Is there still a gender gap in cystic fibrosis?“. Chest. 128 (4): 2824–34. doi:10.1378/chest.128.4.2824. PMID 16236961.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Moran A, Dunitz J, Nathan B, Saeed A, Holme B, Thomas W (September 2009). „Cystic fibrosis-related diabetes: current trends in prevalence, incidence, and mortality“. Diabetes Care. 32 (9): 1626–31. doi:10.2337/dc09-0586. PMC 2732133. PMID 19542209.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ „CF worse for women 'due to effect of estrogen'“. The Irish Times. August 8, 2010.
- ↑ Wennberg C, Kucinskas V (1994). „Low frequency of the delta F508 mutation in Finno-Ugrian and Baltic populations“. Hum. Hered. 44 (3): 169–71. doi:10.1159/000154210. PMID 8039801.
- ↑ Kere J, Savilahti E, Norio R, Estivill X, de la Chapelle A (September 1990). „Cystic fibrosis mutation delta F508 in Finland: other mutations predominate“. Hum. Genet. 85 (4): 413–5. doi:10.1007/BF02428286. PMID 2210753.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Gabriel SE, Brigman KN, Koller BH, Boucher RC, Stutts MJ (October 1994). „Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model“. Science. 266 (5182): 107–9. Bibcode:1994Sci...266..107G. doi:10.1126/science.7524148. PMID 7524148.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Cuthbert AW, Halstead J, Ratcliff R, Colledge WH, Evans MJ (January 1995). „The genetic advantage hypothesis in cystic fibrosis heterozygotes: a murine study“. J. Physiol. (Lond.). 482 (Pt 2): 449–54. doi:10.1113/jphysiol.1995.sp020531. PMC 1157742. PMID 7714835.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Högenauer C, Santa Ana CA, Porter JL, Millard M, Gelfand A, Rosenblatt RL, Prestidge CB, Fordtran JS (December 2000). „Active intestinal chloride secretion in human carriers of cystic fibrosis mutations: an evaluation of the hypothesis that heterozygotes have subnormal active intestinal chloride secretion“. Am. J. Hum. Genet. 67 (6): 1422–7. doi:10.1086/316911. PMC 1287919. PMID 11055897.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Pier GB, Grout M, Zaidi T, Meluleni G, Mueschenborn SS, Banting G, Ratcliff R, Evans MJ, Colledge WH (May 1998). „Salmonella typhi uses CFTR to enter intestinal epithelial cells“. Nature. 393 (6680): 79–82. Bibcode:1998Natur.393...79P. doi:10.1038/30006. PMID 9590693.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Modiano G, Ciminelli BM, Pignatti PF (March 2007). „Cystic fibrosis and lactase persistence: a possible correlation“. Eur. J. Hum. Genet. 15 (3): 255–9. doi:10.1038/sj.ejhg.5201749. PMID 17180122.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Poolman EM, Galvani AP (February 2007). „Evaluating candidate agents of selective pressure for cystic fibrosis“. Journal of the Royal Society, Interface. 4 (12): 91–8. doi:10.1098/rsif.2006.0154. PMC 2358959. PMID 17015291.
- ↑ Williams, N (2006). „Footprint fears for new TB threat“. Current Biology. 16 (19): R821. doi:10.1016/j.cub.2006.09.009.
- ↑ 129.0 129.1 129.2 Busch R (1990). „On the history of cystic fibrosis“. Acta Univ Carol Med (Praha). 36 (1–4): 13–5. PMID 2130674.
- ↑ Fanconi, G.; Uehlinger, E.; Knauer, C. (1936). „Das coeliakiesyndrom bei angeborener zysticher pankreasfibromatose und bronchiektasien“. Wien. Med. Wschr. 86: 753–6.
- ↑ Di Sant'Agnese PA, Darling RC, Perera GA, Shea E (November 1953). „Abnormal electrolyte composition of sweat in cystic fibrosis of the pancreas; clinical significance and relationship to the disease“. Pediatrics. 12 (5): 549–63. PMID 13111855.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Riordan JR, Rommens JM, Kerem B, Alon N, Rozmahel R, Grzelczak Z, Zielenski J, Lok S, Plavsic N, Chou JL (September 1989). „Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA“. Science. 245 (4922): 1066–73. Bibcode:1989Sci...245.1066R. doi:10.1126/science.2475911. PMID 2475911.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Rommens JM, Iannuzzi MC, Kerem B, Drumm ML, Melmer G, Dean M, Rozmahel R, Cole JL, Kennedy D, Hidaka N (September 1989). „Identification of the cystic fibrosis gene: chromosome walking and jumping“. Science. 245 (4922): 1059–65. Bibcode:1989Sci...245.1059R. doi:10.1126/science.2772657. PMID 2772657.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Lee, Tim WR (26 Nov 2013). „Topical cystic fibrosis transmembrane conductance regulator gene replacement for cystic fibrosis-related lung disease“. Topical cystic fibrosis transmembrane conductance regulator gene replacement for cystic fibrosis-related lung disease. 11 (11): CD005599. doi:10.1002/14651858.CD005599.pub4. PMID 24282073. ციტირების თარიღი: 27 October 2014.
- ↑ Ramalho AS, Beck S, Meyer M, Penque D, Cutting GR, Amaral MD (November 2002). „Five percent of normal cystic fibrosis transmembrane conductance regulator mRNA ameliorates the severity of pulmonary disease in cystic fibrosis“. Am. J. Respir. Cell Mol. Biol. 27 (5): 619–27. doi:10.1165/rcmb.2001-0004oc. PMID 12397022.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Tate S, Elborn S (March 2005). „Progress towards gene therapy for cystic fibrosis“. Expert Opin Drug Deliv. 2 (2): 269–80. doi:10.1517/17425247.2.2.269. PMID 16296753.
- ↑ თარგი:OMIM
- ↑ Schwank G, Koo BK, Sasselli V, Dekkers JF, Heo I, Demircan T, Sasaki N, Boymans S, Cuppen E, van der Ent CK, Nieuwenhuis EE, Beekman JM, Clevers H (Dec 5, 2013). „Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients“. Cell Stem Cell. 13 (6): 653–8. doi:10.1016/j.stem.2013.11.002. PMID 24315439.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Dietz HC (August 2010). „New therapeutic approaches to Mendelian disorders“. N. Engl. J. Med. 363 (9): 852–63. doi:10.1056/NEJMra0907180. PMID 20818846.
- ↑ Wilschanski M, Yahav Y, Yaacov Y, Blau H, Bentur L, Rivlin J, Aviram M, Bdolah-Abram T, Bebok Z, Shushi L, Kerem B, Kerem E (October 2003). „Gentamicin-induced correction of CFTR function in patients with cystic fibrosis and CFTR stop mutations“. N. Engl. J. Med. 349 (15): 1433–41. doi:10.1056/NEJMoa022170. PMID 14534336.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Clinical trial number NCT00803205 for "Study of Ataluren (PTC124™) in Cystic Fibrosis" at ClinicalTrials.gov
რესურსები ინტერნეტში

