ნეიტრალიზაციის რეაქცია
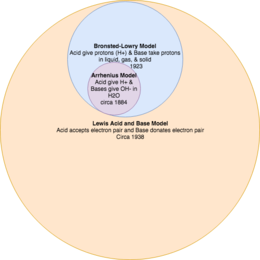
ნეიტრალიზაციის რეაქცია, იგივე ფუძე-მჟავა რეაქცია — ქიმიური რეაქცია, რომელიც მიმდინარეობს ფუძესა და მჟავას შორის, რომელიც შეიძლება გამოყენებული იქნას PH-ის გასანეიტრალებლად. არსებობს უამრავი თეორიები ამ რეაქციასთან დაკავშირებით, ერთ ერთი მათგანია ბროსტედ-ლოვრის მჟავა-ფუძის რეაქციის თეორია.
მათი მნიშვნელობა აშკარა ხდება მჟავის ან ფუძის აირადი და თხევადი სახეობების ანალიზისას. ამ რეაქციის პირველი ნიმუშები წარადგინა ფრანგმა ქიმიკოსმა ანტუან ლავუაზიემ 1776 წელს.[1]
მჟავა-ფუძის განმარტებები
[რედაქტირება | წყაროს რედაქტირება]ისტორიული განვითარება
[რედაქტირება | წყაროს რედაქტირება]ლავუაზიეს ჟანგბადის მჟავის რეაქცია
[რედაქტირება | წყაროს რედაქტირება]პირველის სამეცნიერო ნაშრომი მჟავებსა და ფუძეებზე ეკუთვნის ანტუან ლავუაზეს. ლავუაზიეს ცოდნა ძლიერი მჟავების შესახებ შემცირდა ოქსიდოვან მჟავებამდე როგორიცაა HNO3 და H2SO4, რომლებიც შეიცავენ მაღალ ჟანგბადის რიცხვებს და მათი ცენტრალური ატომები გარშემორტყმულები არიან ჟანგბადებით. მართალია, მან ბევრი არაფერი იცოდა წყალბადის მჟავების შესახებ (Hf, HCl, HBr, HI), მაგრამ მას საკმაოდ დიდი ცოდნა გააჩნდა ჟანგბადოვან მჟავებზე. ანტუან ლავუაზეს აზრმა 30 წელს გაძლო. 1810 წელს კი ჰამფრი დეივიმ თავის ნამუშევარში დაამტკიცა ჟანგბადის არ არსებობა H2S, H2Te ნაერთებში, მაგრამ მან ვერ შეძლო იმის დამტიცება რომ მჟავიანობა არ არის დამოკიდებული ერთ რომელიმე ელემენტზე და დამოკიდებულია ნივთიერებათა ნაერთზე.[2] იენს იაკობ ბერცელიუსმა წარადგინა თეორიები ჟანგბადზე რომლის მიხედვითაც მჟავები არიან არამეტალების ოქსიდები ხოლო ფეძეები არიან მეტალის ოქსიდები.
იუსტუს ლიბიხის წყალბადის თეორია მჟავებში
[რედაქტირება | წყაროს რედაქტირება]1838 წელს იუსტუს ლიბიხმა წარადგინა თეორია რომ მჟავა არის ნივთიერება რომელიც შეიცავს მეტალის ერთ ან რამდენიმე ატომს, რომელსაც წყალბადის ჩანაცვლება შესწევს.[3][4][5] ეს თეორია დაფუძნებული იყო ამავე მეცნიერის ნამუშევარზე ორგანული მჟავების შესახებ.[6]

სვანტე არენიუსის განმარტება
[რედაქტირება | წყაროს რედაქტირება]მჟავების და ფუძეების მოლეკულური ტერმინებით პირველი თანამედროვე განმარტება ეკუთვნის სვანტე არენიუსს,[7][8] წყალბადის თეორია მჟავაში მოჰვა 1884 წლის ნამუშევარი ვილჰელმ ოსტვალდთან ერთად რომელმაც მას 1903 წელს ნობელის პრემია მოაგებინა.
არენიუსი განმარტავს:
- არენიუსის მჟავა არის ნივთიერება შლის წყალს რათა წარმოქმნას წყალბადის იონები (H+).
ეს ან არის წყლის პროტონაციის მიზეზი ან წყალბადიუმის იონის წარმოქმნის მიზეზი (H3O+).[9] დღეს H+ სიმბოლო წარმოადგენს H3O+</sup_ის შემოკლებულ ვარიანტს.
- არესიუსის ფუძეები არის ნივთიერებები, რომლელიც შლის წყალს რათა წარმოქმნას ჰიდროქსიდის (OH−) იონები.
არენიუსის განმარტებები მჟავიანობასა და ტუტიანობაზე შეზღუდულია წყლით და ეხება გამხსნელი იონების კონცენტრაციას. ამ განმარტების მიხედვით სუფთა H2SO4 და HCl (ქლორწყალბადმჟავა) იშლება ტოლუენებათ რომლებიც არ არიან მჟავურები, ამას მივყავართ ლევისის თეორიაზე არაწყალხსნარებთან დაკავშირებით.
საბოლოოდ, ნივთიერებას რომ არენიუსის მჟავა ვუწოდოთ და შეეძლოს წყლის პირდაპირი ან არაპირდაპირი დაშლა, მას უნდა შეეძლოს:
ან
- წყალში შეამციროს ჰიდროქსიდის შემცველობა.
ასევე ნივთიერებას რომ არენიუსის ფუძე ვუწოდოთ და წყლის დაშლა შეძლოს, მას უნდა შეეძლოს:
ან
- წყალში გაზარდოს ჰიდროქსიდის შემცველობა.
ლიტერატურა
[რედაქტირება | წყაროს რედაქტირება]- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2000) Organic Chemistry, First, Oxford University Press.
- Finston, H.L.; Rychtman, A.C. (1983) A New View of Current Acid-Base Theories. New York: John Wiley & Sons.
- Meyers, R. (2003). The Basics of Chemistry. Greenwood Press.
- Miessler, G.L.; Tarr, D.A. (1991) Inorganic Chemistry.
რესურსები ინტერნეტში
[რედაქტირება | წყაროს რედაქტირება]- Acid-base Physiology: an on-line text
- John W. Kimball's online Biology book section of acid and bases.
სქოლიო
[რედაქტირება | წყაროს რედაქტირება]- ↑ Miessler და Tarr 1991, p. 166 – Table of discoveries attributes Antoine Lavoisier as the first to posit a scientific theory in relation to oxyacids.
- ↑ Hall, Norris F. (March 1940). „Systems of Acids and Bases“. Journal of Chemical Education. 17 (3): 124–128. Bibcode:1940JChEd..17..124H. doi:10.1021/ed017p124.
- ↑ Miessler და Tarr 1991
- ↑ Meyers 2003, p. 156
- ↑ Miessler და Tarr 1991, p. 166 – table of discoveries attributes Justus von Liebig's publication as 1838
- ↑ Finston და Rychtman 1983, p. 140–146
- ↑ Miessler G.L. and Tarr D.A. Inorganic Chemistry (2nd ed., Prentice-Hall 1999) p. 154 ISBN 0-13-841891-8
- ↑ Whitten K.W., Galley K.D. and Davis R.E. General Chemistry (4th ed., Saunders 1992) p. 356 ISBN 0-03-072373-6
- ↑ Miessler და Tarr 1991, p. 165
