ძმარმჟავა
| ძმარმჟავა | |
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | ძმარმჟავა[1] |
| ტრადიციული სახელწოდება | ძმარი (განზავებული) წყალბადის აცეტატი |
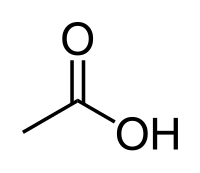
| ქიმიური ფორმულა | C2H4O2 |
| მოლური მასა | 60.052 გ/მოლი |
| ფიზიკური თვისებები | |
| მდგომარეობა (სტ. პირ.) | უფერო სითხე |
| სიმკვრივე | 1.049 გ/სმ³ |
| თერმული თვისებები | |
| დნობის ტემპერატურა | 16-17 °C |
| დუღილის ტემპერატურა | 118-119 °C |
| ქიმიური თვისებები | |
| pKa | 9.24 |
| NFPA 704 | |
ძმარმჟავა — ორგანული ნივთიერება, ქიმიური ფორმულით CH3COOH (ასევე წერენ, როგორც CH3CO2H ან C2H4O2). აქვს დამახასიათებელი სუნის და არის უფერო, თხევადი ნივთირება. წარმოადგენს პოლივინილის აცეტატისა და ცელულოზას აცეტატის პრეცუსორს. განზავებული ძმარმჟავა არის სუსტი მჟავა, თუმცა კონცენტრირებული ძლიერ კოროზიულია და იწვევს კანის დაზიანებას.
ძმარმჟავა არის მეორე ყველაზე მარტივი კარბოქსილის მჟავა (ჭიანჭველამჟავას შემდეგ). მის მოლეკულაში კარბოქსილის ფუნქციურ ჯგუფს უკავშირდება მეთილის რადიკალი. ყოველდღიურ ცხოვრებაში გამოიყენება განზავებული სახით, რომელსაც ძმარს უწოდებენ. ძირითადად მიიღება მეთანოლისგან,[2] მაგრამ ვინაიდან ძმარი ძლიერ განზავებული ძმარმჟავაა, ხშირად ეთანოლისგან აწარმოებენ.
წარმოება[რედაქტირება | წყაროს რედაქტირება]
მეთანოლის კარბოქსილაცია[რედაქტირება | წყაროს რედაქტირება]
ძმარმჟავა მიიღება მეთანოლისა და ნახშირბადის მონოოქსიდის რეაქციით:
მიიღება მეთანოლისა და იოდწყალბადმჟავას რეაქციით, სადაც იოდომეთანი არის ინტერმედიატი (შუალედური პროდუქტი) და რეაქცია მიმდინარეობს სამ ეტაპად. მეორე ეტაპზე, კარბონილიზაციისას, კატალიზატორად გამოიყენება ლითონის კარბონილი.[3] აცეტილიოდიდის ჰიდროლიზით კი მიიღება ძმარმჟავა:
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
აცეტალდეჰიდის დაჟანგვა[რედაქტირება | წყაროს რედაქტირება]
ძმარმჟავას ასევე იღებენ აცეტალდეჰიდის დაჟანგვით. ეს იყო პირველი მეთოდი, რომელიც არ მოიცავდა მეთანოლის კარბოქსილაციას. აცეტალდეჰიდი მიიღება აცეტილენის ჰიდრატაციით. ეს მეთოდი გავრცელებული იყო 1900-იან წლებამდე.[4]
- 2 CH3CHO + O2 → 2 CH3CO2H
გამოყენება[რედაქტირება | წყაროს რედაქტირება]

ძმარმჟავა არის ქიმიური რეაგენტი, რომელიც მრავალი პროდუქტის მისაღებად გამოიყენება. მისგან ამზადებენ ვინილის აცეტატის მონომერს, ძმარმჟავას ანჰიდრიდს და ძმარს.[2][5]
ვინილ აცეტატის მონომერი[რედაქტირება | წყაროს რედაქტირება]
ძმარმჟავას ძირითადად იყენებენ ვინილის აცეტატის დასამზადებლად, რაც მოიცავს ეთილენისა და ძმარმჟავას ურთიერთქმედებას აირად ფაზაში და ჟანგბადის არეში. კატატიზატორად გამოიყენება პალადიუმი.[6]
- 2 H3C−COOH + 2 C2H4 + O2 → 2 H3C−CO−O−CH=CH2 + 2 H2O
მონომერის პოლიმერიზაციით მიიღება პოლივინილის აცეტატი ან სხვა პოლიმერი, რომლებსაც იყენებენ საღებავებისა და წებოების დასამზადებლად[6]
ძმარმჟავას ანჰიდრიდი[რედაქტირება | წყაროს რედაქტირება]
ძმარმჟავას ანჰიდრიდი მიიღება ძმარმჟავას ორი მოლეკულის დეჰიდრატაციით. 700–750 °C-ზე გახურებისას ძმარმჟავასგან ფორმირდება კეტენი, რომელიც შედის რეაქციაში სხვა მოლეკულასთან და წარმოქმნის ანდიდრიდს:[7]
- CH3CO2H → CH2=C=O + H2O
- CH3CO2H + CH2=C=O → (CH3CO)2O
ძმარმჟავას ანჰიდრიდის ძირითადი დანიშნულება აცეტილაციაა. მისგან მიიღება ჰეროინი და სხვა მრავალი ქიმიური ნივთიერება.
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ (2014) Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry, გვ. 745. DOI:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ↑ 2.0 2.1 Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul. "Acetic Acid". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_045.pub2.
- ↑ Yoneda, N.; Kusano, S.; Yasui, M.; Pujado, P.; Wilcher, S. (2001). „Recent advances in processes and catalysts for the production of acetic acid“. Applied Catalysis A: General. 221 (1–2): 253–265. doi:10.1016/S0926-860X(01)00800-6.
- ↑ Hintermann, Lukas; Labonne, Aurélie (2007). „Catalytic Hydration of Alkynes and Its Application in Synthesis“. Synthesis. 2007 (8): 1121. doi:10.1055/s-2007-966002.
- ↑ (2003) „Acetic Acid“, Chemicals Economic Handbook. SRI International, გვ. 602.5000.
- ↑ 6.0 6.1 Roscher, Günter. "VInyl Esters". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_419.
- ↑ Held, Heimo; Rengstl, Alfred; Mayer, Dieter. "Acetic Anhydride and Mixed Fatty Acid Anhydrides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_065.

