იზომერია

იზომერია (ძვ. ბერძნ. ἴσος — „ტოლი“, და μέρος — „წილი, ნაწილი“) — მოვლენა, ქიმიური ნაერთების (იზომერები) არსებობისა, რომლებსაც აქვთ ერთნაირი შემადგენლობა და მოლეკულური მასა, მაგრამ აღნაგობით ან ატომების მდებარეობით სივრცეში განსხვავდებიან და ამის შედეგად განსხვავდებიან თვისებებითაც.
ისტორიული ცნობები
[რედაქტირება | წყაროს რედაქტირება]იუსტუს ლიბიხის და ფრიდრიხ ველერის დისკუსიის შედეგად დადგენილ იქნა (1823), რომ არსებობენ ორი მკვეთრად განსხვავებული თვისებების ნივთიერებები შემადგენლობით AgCNO — ციანმჟავიანი ვერცხლი (AgNCO) და AgONC. კიდევ ერთ მაგალითია ღვინის და ყურძნის მჟავეები, რომელთა გამოკვლევების შემდეგ იაკობ ბერცელიუსმა 1830 წელს შემოიღო ტერმინი «იზომერია» და გამოთქვა ვარაუდი, რომ განსხვავებები წარმოიშვება «რთულ ატომებში მარტივი ატომების განსხვავებული განთავსებით» (ანუ, თანამედროვე ტერმინით, მოლეკულაში).
ნამდვილი განმარტება იზომერიამ მიიღო მხოლოდ XIX ს. მე-2 ნახევარში, მიხეილ ბუტლეროვის ქიმიური აღნაგობის თეორიის საფუძველზე (სტრუქტურული იზომერია) და იაკობ-ჰენდრიკ ვანტ-გოფის სტერეოქიმიურ სწავლების (სივრცული იზომერია) საფუძველზე.
სტუქტურული იზომერია
[რედაქტირება | წყაროს რედაქტირება]სტრუქტურული იზომერია — ეს არის ქიმიური აღნაგობის განსხვავებულობის შედეგი. ამ ტიპს მიეკუთვნებიან:
ნახშირწყალბადური ჯაჭვის იზომერია (ნახშირბადული ჩონჩხი)
[რედაქტირება | წყაროს რედაქტირება]
ნახშირბადული ჩონჩხის იზომერია, განპირობებულია ნახშირბადის ატომების კავშირების სხვადასხვაგვარობით. უმარტივესი მაგალითია — ბუტანი (ქიმია) СН3—СН2—СН2—СН3 და იზობუტანი (СН3)3СН. სხვა მაგალითები: ანტრაცენი და ფენანტრენი (I და II ფორმულები შესაბამისად), ციკლობუტანი და მეთილციკლოპროპანი (III და IV).
ვალენტური იზომერია
[რედაქტირება | წყაროს რედაქტირება]
ვალენტური იზომერია — ეს არის სტრუქტურული იზომერიის განსაკუთრებული სახე, რომლის დროსაც იზომერები შეიძლება გადავიყვანოთ ერთმანეთში მხოლოდ კავშირების გადანაწილებით. მაგალითად, ვალენტური იზომერები ბენზოლი (V) წარმოადგენს ბიციკლ[2.2.0]ჰექსა-2,5-დიენი (VI, «დიუარის ბენზოლი»), პრიზმანი (VII, «ლადენბურგის ბენზოლი»), ბენზვალენი (VIII).
ფუნქციონალური ჯგუფის იზომერია
[რედაქტირება | წყაროს რედაქტირება]ფუნქციონალური ჯგუფები განსხვავდებიან ხასიათით; მაგალითად, ეთანოლი (CH3—CH2—OH) და დიმეთილის ეთერი (CH3—O—CH3).
მდგომარეობის იზომერია
[რედაქტირება | წყაროს რედაქტირება]სტრუქტურული იზომერიის ტიპი, რომლებიც ხასიათდებიან ერთნაირი ფუნქციონალური ჯგუფების ან ორმაგი კავშირების მდგომარეობის სხვაობით, ერთნაირი ნახშირბადის ჩონჩხისას. მაგალითად: 2-ქლორბუტანის მჟავა და 4-ქლორბუტანის მჟავა.
სივრცული იზომერია (სტერეოიზომერია)
[რედაქტირება | წყაროს რედაქტირება]სივრცული იზომერია (სტერეოიზომერია) წარმოიქმნება მოლეკულის სივრცული კონფიგურაციის სხვაობის შედეგად, რომლებსაც გააჩნიათ ერთნაირი ქიმიური აღნაგობა. სხვადასხვა ტიპის სივრცული იზომერების აღსანიშნავად დამუშავებულია სტერეოქიმიური ნომენკლატურა, რომელიც შეგროვილია ქიმიის იუპაკ-ის ნომენკლატურის (IUPAC) განყოფილება E-ში.
იზომერიის ამ ტიპიდან გამოყოფენ ენანტიომერიას (ოპტიკური იზომერია) და დიასტერეომერია.
ენანტიომერია (ოპტიკური იზომერია)
[რედაქტირება | წყაროს რედაქტირება]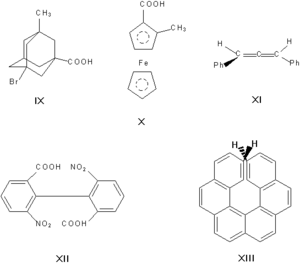
ენანტიომერებს (ოპტიკურ იზომერებს, სარკულ იზომერებს) წარმოადგენს ოპტიკური ანტიპოდების წყვილს — ნივთიერებებს, რომლებიც ხასიათდებიან შუქის პოლარიზაციის სიბრტყის ბრუნვის ურთიერთსაწინაამდეგო ნიშნით და ერთნაირი სიდიდით, ფიზიკური და ქიმიური თვისებების (სხვა ოპტიკურად აქტიურ ნივთიერებებთან რეაქციის გარდა) იდენტურობის პირობებში. საჭირო და აუცილებელი მიზეზი ოპტიკური ანტიპოდების წარმოქმნისა არის — მოლეკულის კუთვნილება ერთ-ერთი შემდეგი სიმეტრიის წერტილოვანი ჯგუფისა: Cთარგი:Sub, Dთარგი:Sub, T, O ან I. ყველაზე ხშირად საუბარია ნახშირბადის ასიმეტრიულ ატომზე, ანუ ატომზე, რომელიც დაკავშირებულია ოთხ სხვადასხვა შემცვლელებთან.
ასიმეტრიულნი შეიძლება სხვა ატომებიც იყვნენ, მაგალითად სილიციუმის, აზოტის, ფოსფორის, გოგირდის ატომები. ასიმეტრიული ატომის არსებობა — არაა ენანტიომერიის ერთადერთი მიზეზი. მაგალითად, ოპტიკური ანტიპოდები გააჩნიათ ადამანტანის (IX), ფეროცენის (X), 1,3-დიფენილალენის (XI), 6,6'-დინიტრო-2,2'-დიფენის მჟავისა (XII) წარმოებულებს. ბოლო ნივთიერების ოპტიკური აქტივობის მიზეზია — ატრაპოიზომერია, ანუ სივრცული იზომერია, რომელიც გამოწვეულია მარტივი კავშირის ირგვლივ ბრუნის არარსებობით. ენანტომერია ასევე ვლინდება ცილების სპირალურ კონფორმაციაში, ნუკლეინის მჟავეებში, ჰექსაგელიცენი (XIII).
დიასტერეომერია
[რედაქტირება | წყაროს რედაქტირება]დისტერემერულად ითვლება სივრცული იზომერების ყოველი კომბინაცია, რომლებიც არ შეადგენენ ოპტიკური ანტიპოდების წყვილებს. განასხვავებენ σ- და π-დიასტერეომერებს.
σ—დიასტერეომერია
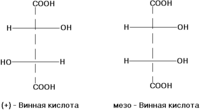
[რედაქტირება | წყაროს რედაქტირება]σ-დიასტერეომერები ერთმანეთისაგან განსხვავდებიან ნაწილების კონფიგურაციით რომლებშიც არის ქირალობის ელემენტები. დიასტერეომერებს წარმოადგენენ (+)-ღვინის მჟავა და მეზო=ღვინის მჟავა, D-გლუკოზა და D-მანოზა, მაგალითად:
π—დიასტერეომერია (გეომეტრიული იზომერია)
[რედაქტირება | წყაროს რედაქტირება]π-დიასტერეომერები, რომლებსაც უწოდებენ ასევე გეომეტრიულ იზომერებს, ერთმანეთისაგან განსხვავდებიან შემცვლელების სხვადასხვანაირი სივრცული განლაგებით ორმაგი კავშირების სიბრტყის მიმართ (ყველაზე ხშირად С=С და С=N) ან ციკლის მიმართ. მათ მიეკუთვნებიან, მაგალითად, მალეინის მჟავა და ფუმარის მჟავა (ფორმულები XIV და XV შესაბამისად), (Е)- და (Z)-ბენზალდოქსიმები (XVI და XVII), ცის- და ტრანს-1,2-დიმეთილციკლოპენტანი (XVIII და XIX).
იზომერიზაცია
[რედაქტირება | წყაროს რედაქტირება]ქიმიურ გარდაქმნებს, რომელთა შედეგად სტრუქტურული იზომერები გარდაიქმნებიან ერთმანეთედ, ეწოდება იზომერიზაცია. ასეთი პროცესები ძალიან მნიშვნელოვანნი არიან მრეწველობისათვის. ასე მაგალითად, ნორმალური ალკანების იზომერიზაციას იზოალკანებად აწარმოებენ ძრავების საწვავების ოქტანური რიცხვის ასამაღლებლად; პენტანის იზომერიზაციას იზოპენტანად ახდენენ იზოპრენის შემდგომი დეჰიდრირებისათვის. იზომერიზაციას წარმოადგენს ასევე შიდა მოლეკულური გადაჯგუფებები, რომელთაგან დიდი მნიშვნელობა აქვს მაგალითად, ბეკმანის გადაჯგუფებას — ციკლოჰექსანონოქსიმის გარდაქმნა კაპროლაკტამად (კაპრონის წარმოების ნედლეული).
ენანტიომერების ურთიერთ გარდაქმნების პროცესს ეწოდება რაცემიზაცია: ეკვიმოლური ნარევების (-)- და (+)- ფორმების, ანუ რეცამენტის წარმოქმნის შედეგად ხდება ოპტიკური აქტივობის დაკარგვა. დიასტერეომერების ურთიერთგარდაქმნებისას წარმოიქმნება ნარევები, რომლებშიც ჭარბობს თერმოდინამიკური უფრო მდგრადი ფორმა. π-დიასტერეომერების შემთხვევაში ეს ჩვეულებრივ არის ტრანს-ფორმა. კონფორმაციული იზომერების ურთიერთ გარდაქნებს ეწოდება კონფორმაციული წონასწორობა.
იზომერიის მოვლენა დიდად ხელს უწყობს ცნობილი (და უფრო მეტის კი - პოტენციური შესაძლებელის) ნაერთების რაოდენობის ზრდას. ასე მაგალითად, იზომერული დეცილური სპირტების რაოდენობა - 500 მეტია (მათგან ცნობილია მიახლოებით 70), სივრცული იზომერები აქ 1500-ზე მეტია.
იზომერიის პრობლემების თეორიული განხილვისას სულ უფრო მეტ გავრცელებას პოულობს ტოპოლოგიური მეთოდი; იზომერების რაოდენობის დასათვლელად გამოყვანილია მათემატიკური ფორმულები.
იხილეთ აგრეთვე
[რედაქტირება | წყაროს რედაქტირება]
ლიტერატურა
[რედაქტირება | წყაროს რედაქტირება]- ლ. ფიზერი, მ. ფიზერი, ორგანული ქიმია. გაღრმავებული კურსი. ტ.1. თარგმნ. ინგლის., რედ. ნ. ვულსონი. გამომც. «ქიმია». მ., 1969.
- ა.ვ. პალმი, თეორიული ორგანული ქიმიის შესავალი, მ., 1974;
- ვ.ი. სოკოლოვი, თეორიული სტერეოქიმიის შესავალი, მ., 1979;
- ზ. სლანინა, იზომერიის მოვლენის თეორიული ასპექტები ქიმიაში, თარგმნ. ჩეხ., მ., 1984;
- ვ.მ. პოტაპოვი, სტერეოქიმია მ., 1988.
- დიდი ენციკლოპედიური ლექსიკონი. ქიმია. გამ.: დიდი რუსული ენციკლ., 2003, ISBN 5-85270-253-6