დიაზოტის პენტოქსიდი
| დიაზოტის პენტოქსიდი | |
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | აზოტოვანი ანჰიდრიდი ნიტრონიუმის ნიტრატი ნიტრილის ნიტრატი DNPO უწყლო აზოტმჟავა |
| ქიმიური ფორმულა | N2O5 |
| მოლური მასა | 108.01 გ/მოლი |
| ფიზიკური თვისებები | |
| მდგომარეობა (სტ. პირ.) | თეთრი მყარი ნივთიერება |
| სიმკვრივე | 1.642 (18 °C) გ/სმ³ |
| თერმული თვისებები | |
| დნობის ტემპერატურა | 41 °C |
| დუღილის ტემპერატურა | 47 °C |
| თვითაალების ტემპერატურა | არააალებადი °C |
| ხსნადობა ნივთიერებაში წყალი | რეაქციაში შედის და წარმოქმნისHNO3-ს გ/100 მლ |
| ხსნადობა ნივთიერებაში ქლოროფორმში უსაზღვროდ ხსნადია CCl4-ში | ხსნადია გ/100 მლ |
| სტრუქტურა | |
| კრისტალური სტრუქტურა | ჰექსაგონალური |
| დიპოლური მომენტი | 1.39 დ |
| უსაფრთხოება | |
| რისკის ფრაზები | ძლიერი მჟანგავია. წყალთან შეხებისას წარმოქმნის აზოტმჟავას. |
| კლასიფიკაცია | |
| CAS | 10102-03-1 |
| PubChem | 66242 |
| EINECS | 233-264-2 |
| SMILES |
|
დიაზოტის პენტოქსიდი ქიმიური ნივთიერებაა ფორმულით N2O5. ის ასევე ცნობილია სახელით აზოტის პენტოქსიდი. N2O5 წარმოადგენს ერთ-ერთ ბინარულ აზოტის ოქსიდს, ერთ-ერთს ნაერთების ოჯახიდან, რომლებიც აზოტისა და ჟანგბადისაგან შედგებიან. ის არასტაბილური და საშიში მჟანგავია, რომელსაც წარსულში ქლოროფორმის ხსნარის სახით იყენებდნენ ნიტრირების რეაქციაში და რომელიც ძირითადად ჩანაცვლდა გაცილებით უსაფრთხო ნიტრონიუმის ტეტრაფთორბორატით (NO2BF4)
N2O5 იმ იშვიათი ნივთიერებების სიიდანაა, რომლებიც სტრუქტურას გარემო პირობებზე დამოკიდებულებით იცვლიან: ზოგადად ის მარილია, მაგრამ ზოგიერთ შემთხვევაში პოლარული მოლეკულის სტრუქტურას იძენს:
- [NO2+][NO3−] ⇌ N2O5
სინთეზი და თვისებები[რედაქტირება | წყაროს რედაქტირება]
N2O5 პირველად 1840 წელს დევილმა(Deville) მიიღო AgNO3-ზე ქლორის მოქმედებით.[1][2] ლაბორატორიაში მისაღებად რეკომენდებული გზა აღიწერება როგორც აზოტმჟავის დეჰიდრატაცია ტეტრაფოსფორის დეკაოქსიდით:[3]
- P4O10 + 12 HNO3 → 4 H3PO4 + 6 N2O5
პროცესის შებრუნებისას N2O5 რეაქციაში შედის წყალთან (განიცდის ჰიდროლიზს) აზოტმჟავის წარმოქმნით, ანუ აზოტის პენტოქსიდი აზოტმჟავის ანჰიდრიდს წარმოადგენს:
- N2O5 + H2O → 2 HNO3
N2O5 უფერო კრისტალებია, რომლებიც ოთახის ტემპერატურაზე ოდნავ მაღლა სუბლიმაციას განიცდიან. დროთა განმავლობაში მარილი აზოტის დიოქსიდად და ჟანგბადად იშლება.[4]
სტრუქტირა[რედაქტირება | წყაროს რედაქტირება]
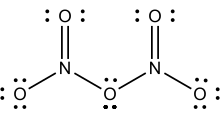
მყარი N2O5 მარილია, რომელიც განცალკევებული ანიონებისა და კათიონებისაგან შედგება. კათიონი წრფივი ნიტრონიუმის იონი NO2+-ა, ანიონი კი ბრტყელ ნიტრატის NO3− იონს წარმოადგენს. ამიტომ ამ მყარ მასას შეიძლება ნიტრონიუმის ნიტრატი ვუწოდოთ. მასში აზოტის ორივე ცენტრი დაჟანგულობის ხარისხ +5-ის მატარებელია.
N2O5-ის სუბლიმაციისას მიღებულ აირად მდგომარეობაში მისი მოლეკულის განლაგება იცვლება და იძენს ფორმულას O2N–O–NO2. იგივე შედეგი მიიღწევა მყარი მასის ისეთ არაპოლარულ გამხსნელებში გახსნიას, როგორებიცაა ნახშირბადის ტეტრაქლორიდში. აირად მდგომარეობაში O–N–O ბმის კუთხე 133°-ია და N–O–N-ის 114°. როცა აირადი N2O5 მომენტალურად იყინება, ის იძენს მეტასტაბილურ მოლეკულურ ფორმას, რომელიც −70 °C-ის ზემოთ ეგზოთერმულად გადადის იონურ ფორმაში.[3]
რეაქციები და გამოყენება[რედაქტირება | წყაროს რედაქტირება]
დიაზოტის პენტოქსიდის ხსნარი, მაგალითად ქლოროფორმში გამოიყენებოდა NO2 ფუნქციონალური ჯგუფის ნივთიერებაში შესაყვანად. ამ რეაქციას ნიტრირება ეწოდება და შემდეგნაირად გამოიყურება:
- N2O5 + Ar–H → HNO3 + Ar–NO2
სადაც Ar არენის ნაწილს წარმოადგენს.
N2O5 ყველაზე ხშირად ასაფეთქებელი ნივთიერებების წარმოებისას გამოიყენება.[2][5]
ატმოსფეროში დიაზოტის პენტოქსიდი NOx ნაერთების, რომლებიც ოზონის შრის დაშლის ძირითად ინიციატორები არიან, რეზერვუარს წარმოადგენს: მისი წარმოქმნა წარმოადგენს ნულოვან ციკლს, სადაც NO და NO2 დროებით არააქტიურ მდგომარეობაში იმყოფებიან.
NO2BF4[რედაქტირება | წყაროს რედაქტირება]
ნაერთ N2O5-ის NO3− ნაწილის BF4−-ით ჩანაცვლებით მივიღებთ ნიტრონიუმის ტეტრაფთორბორატს (NO2BF4, CAS#13826-86-3). აღნიშნული მარილი ისეთივე აქტიურია როგორც NO2+, მაგრამ თერმულად მდგრადია და იშლება მხოლოდ დაახლ. 180 °C ტემპერატურის დროს. (დაშლის პროდუქტებს წარმოადგენენ NO2F და BF3. NO2BF4 ბევრი ორგანული ნივთიერების ნიტრირებისათვის გამოიყენება. განსაკუთრებულად შეიძლება აღინიშნოს არენებისა და ჰეტეროციკლური ნივთიერებების ნიტრირება. NO2+ ჯგუფის აგრესიულობის შემდგომი გაზრდა შესაძლებელია ძლიერი მჟავებით, რომლებიც "ზე-ელექტროფილურ" HNO22+-ს წარმოქმნიან.
საფრთხე[რედაქტირება | წყაროს რედაქტირება]
N2O5 ძლიერი მჟანგავია, რომელიც ბევრ ამონიუმის მარილთან და ორგანულ ნაერთთან ფეთქებად ნარევებს ქმნის. მისი დაშლისას კი ძლიერ ტოქსიკური აზოტის დიოქსიდი გამოიყოფა
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ M.H. Deville (1849). „Note sur la production de l'acide nitrique anhydre“. Compt. Rend. 28: 257–260.
- ↑ 2.0 2.1 Jai Prakash Agrawal (19 April 2010). High Energy Materials: Propellants, Explosives and Pyrotechnics. Wiley-VCH, გვ. 117–. ISBN 978-3-527-32610-5. ციტირების თარიღი: 20 September 2011.
- ↑ 3.0 3.1 თარგი:Holleman&Wiberg
- ↑ (1950) Nitrogen(V) Oxide, Inorganic Syntheses, გვ. 78–81.
- ↑ Talawar, M. B.; et al. (2005). „Establishment of Process Technology for the Manufacture of Dinitrogen Pentoxide and its Utility for the Synthesis of Most Powerful Explosive of Today—CL-20“. Journal of Hazardous Materials. 124: 153–64. doi:10.1016/j.jhazmat.2005.04.021.
