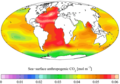
ოკეანის გამჟავიანება


ოკეანის გამჟავიანება — პროცესი, რომელიც მოიცავს ოკეანეების pH- ის დაწევას, რაც გამოწვეულია ატმოსფეროში ნახშირბადის დიოქსიდის რაოდენობის ზრდით.[1] ზღვის წყალს ოდნავ ტუტე თვისებები აქვს და მისი pH > 7-ზე, ამიტომაც ოკეანის გამჟავიანება გულისხმობს pH- ის ნეიტრალურში გადასვლას, ნაცვლად მჟავე გარემოში გადასვლისა, როცა pH < 7-ზე.[2] ნახშირორჟანგი, რომელიც გამოყოფილია ადამიანთა საქმიანობის შედეგად, მისი 30-40% შთაინთქმება ოკეანეების, მდინარეებისა და ტბების მიერ.[3][4] მისი ნაწილი კი რეაქციაში შედის წყალთან და წარმოქმნის ნახშირმჟავას. შედეგად კი ნახშირმჟავას მოლეკულები დისოცირდებიან წყალბადის კათიონად და ბიკარბონატის ანიონად, რაც ზრდის მჟავიანობის მაჩვენებელს. 1751-1996 წლებს შორის, ზედაპირის ოკეანის pH სავარაუდოდ შემცირდა დაახლოებით 8,25-დან 8,14-მდე,[5]რაც მსოფლიო ოკეანეებში H+ იონის კონცენტრაციის თითქმის 30% -იან ზრდას ნიშნავს.[6][7]
მჟავიანობის მატებას, სავარაუდოდ, მოჰყვება მავნე შედეგები წყლის ორგანიზმებისთვის, როგორიცაა მეტაბოლური სიჩქარისა და იმუნური სისტემის დაქვეითება, ასევე იგი იწვევს მარჯნის გაუფერლებას.[8]თავისუფალი წყალბადის იონების ზრდა, დამატებით კი ნახშირმჟავა, რომელიც წარმოიქმნება ოკეანეებში, საბოლოოდ კარბონატის იონებიდან გადაიქცევა ბიკარბონატულ იონებად, რაც დიდ გავლენას ახდენს მჟავიანობაზე და ცოცხალ ორგანიზმებზე.[9] კარბონატის ბიკარბონატში გადასვლა დიდ საფრთხეს უქმნის კალციფიკურ არსებებს, რომლებისთვისაც ბევრად რთული ხდება კარბონატური საფარის შექმნა, ასეთი ორგანიზმებია, მაგალითად, მარჯანი და ზოგიერთი სახეობის პლანქტონი, ხოლო მათი საფარის სტრუქტურა გახდება დაშლადი.[10] გამჟავიანებამ ასევე შესაძლოა დაარღვიოს ოკეანეების კვებითი ჯაჭვი.[11][12]
მიუხედავად იმისა, რომ მიმდინარე პერიოდში ოკეანეში მჟავიანობის ზრდა ნაწილობრივ ანთროპოგენურია, დედამიწის ისტორიაში ადრეც მომხდარა მსგავსი ფაქტი,[13] და შედეგად წარმოქმნილ ეკოლოგიურ კოლაფსს ოკეანეებში, ხანგრძლივი გავლენა ჰქონდა ნახშირბადის გლობალურ ციკლსა და კლიმატზე.[14][15] ყველაზე ნათელი მაგალითია „PETM“, თერმული მაქსიმუმი,[16] რომელიც მოხდა დაახლოებით 56 მილიონი წლის წინ, როდესაც ნახშირორჟანგის რაოდენობა მკვეთრად გაიზარდა ოკეანეებსა და ატმოსფეროში, რამაც ასევე გამოიწვია კარბონატული ნალექების დაშლა ყველა ოკეანეში.
ოკეანის მჟავიანობა შედარებულია ანთროპოგენური კლიმატის ცვლილებასთან და მას უწოდებენ „გლობალური დათბობის ბოროტ ტყუპს“.[17][18][19][20][21] ასევე სხვა ნახშირორჟანგის პრობლემებთან ერთად,[18][20][22] აღსანიშნავია, რომ მტკნარი წყლებიც მჟავიანდება, რომელიც უფრო კომპლექსურ პრობლემას წარმოადგენს.[23][24]
ნახშირბადის ციკლი[რედაქტირება | წყაროს რედაქტირება]

ნახშირბადის ციკლი მოიცავს ნახშირორჟანგის ნაკადების მოძრაობას ოკეანეებში, ბიოსფეროში, ლითოსფეროსა[25] და ატმოსფეროში. ადამიანთა მიერ წიაღისეული საწვავის ჭარბმა გამოყენებამ, დედამიწაზე ახალი ნახშირორჟანგის ნაკადი წარმოშვა. აქედან 47% ატმოსფეროში დარჩა, დანარჩენი შთაინთქა ოკეანეებისა[26] და ხმელეთის მცენარეების მიერ.[27]
ნახშირბადის ციკლი ასევე მოიცავს ორგანულ ნივთიერებებსაც, როგორიცაა ცელულოზა და არაორგანულ ნახშირბადის ნივთიერებებსაც, როგორიცაა ნახშირბადის დიოქსიდი, კარბონატისა და ბიკარბოატის იონი, თუმცა გამჟავიანებით საფრთე უფრო მეტად არაორგანულ ნივთიერებებს ემუქრებათ, რადგან CO2-ს შეუძლია მათი დაშლა.[28]
როდესაც CO2 წყალში გაიხსნება, იგი რეაქციაში შედის წყალთან, რათა შეიქმნას იონური და არაიონური ქიმიური ბალანსი, ამიტომაც წყალი შიეიცავს შემდეგ ნივთიერებებს: (CO2(ხს)), ნახშირმჟავა (H2CO3), ბიკარბონატი (HCO3−) და კარბონატი (CO32−). ამ ნივთიერებების რაოდენობა დამოკიდებულია ზღვის წყლის ტემპერატურაზე, მარილიანობასა და წნევაზე.
გამჟავიანება[რედაქტირება | წყაროს რედაქტირება]
CO2-ის გახსნა წყალში ზრდის წყალბადის კათიონების (H+) კონცენტრაციას, რაც შესაბამისად ამცირებს pH-ის მაჩვენებელს.[29]
სამრეწველო რევოლუციის დაწყების შემდგომ, ოკეანეებმა შეიწოვეს გამოყოფილი CO2-ის მესამედი, ხოლო ნახშირორჟანგს ჩვენ მას შემდეგ ვაწარმოებთ.[30] თუ pH 0,1-ით დაიწევს, ეს ნიშნავს , რომ წყალბადის კათიონების კონცენტრაციამ 29%-ით მოიმატა, ვინაიდან pH-ის შკალა ლოგარითმულია. სამომავლოდ ვარაუდობენ რომ შკალა დაიწევს 0,3-დან 0,5-მდე pH ერთეულით.[31] გამოყოფის ეს პროცესი უფრო და უფრო მეტად იზრდება, ხოლო ეს გამოიწვევს ოკეანის ქიმიის ცვლილებას, მისივე pH- ის ჩათვლით, ხოლო ყველაფერი დამოკიდებულია ადამიანებზე და მათ მიერ გამოყოფილ ნახშირორჟანგზე.[32][33]
მიუხედავად იმისა, რომ უდიდესი ცვლილებებია მოსალოდნელი მომავალში,[10] NOAA- ის მეცნიერების მიერ გამოქვეყნებულ დასკვნაში ნათქვამია, რომ დიდი რაოდენობის წყლის კონცენტრაცია, დაუმუშავებელი არაგონიტით, უკვე იზრდება ჩრდილოეთ ამერიკის წყნარი ოკეანის კონტინენტურ შელფთან ახლოს.[34]
კონტინენტური შელფები მნიშვნელოვან როლს ასრულებენ წყლალქვეშა ეკოსისტემებში, რადგან წყლის ორგანიზმების უმეტესობა აქ ცხოვრობს ან გვხვდება, და მიუხედავად იმისა, რომ კვლევა მხოლოდ ვანკუვერიდან ჩრდილოეთ კალიფორნიაში მდებარე ტერიტორიამდე ხდებოდა, მეცნიერები ვარაუდობენ, რომ სხვა შელფის რაიონებში შესაძლოა მსგავსი სიტუაცია იყოს.[34]
კალციფიკაცია[რედაქტირება | წყაროს რედაქტირება]
მიმოხილვა[რედაქტირება | წყაროს რედაქტირება]
ოკეანის ქიმიის ცვლილებებს შეიძლება ჰქონდეს პირდაპირი და არაპირდაპირი ზემოქმედება ორგანიზმებზე, პირველ რიგში მჟავიანობა ხელს უშლის ორგანიზმებს, რათა წარმოქმნან კალციუმის კარბონატის (CaCO3) საფარი, მაგალითად ნიჟარა, რაც აუცილებელი კომპონენტია მათი არსებობისთვის.[35] პროცესი კალციფიკაცია ძალზე მნიშვნელოვანია ბიოლოგიასა და მარჯნის მსგავსი ორგანიზმებების გადარჩენისთვის. ტერმინი გულისხმობს გახსნილი იონებისგან მყარი კალციუმის კარბონატის საფარის მიღებას, თუმცა ასეთი საფარი დაუცველია დაშლისგან, თუ ზღვის წყალი არ არის გაჯერებული კარბონატის იონებით (CO32−).
მექანიზმი[რედაქტირება | წყაროს რედაქტირება]

ოკეანეებში მოხვედრილი ნახშირორჟანგიდან ზოგი რჩება, როგორც ნახშირორჟანგი, ხოლო დანარჩენი ხელს უწყობს ბიკარბონატისა და ნახშირმჟავს მიღებას. შემდეგ ეს ზრდის წყალბადის იონების კონცენტრაციას, ხოლო წყალბადის პროცენტული მატება უფრო მეტია, ბიკარბონატის პროცენტულ მატებასთან შედარებით.[36]
წარმოიქმნება შექცევადი რეაქცია HCO3− ⇌ CO32− + H+. წყალბადის იონი უერთდება კარბონატის იონს და მიიღება ბიკარბონატი, ანუ მცირდება კარბონატის კონცენტრაცია, რაც იწვევს შემდეგ დისბალანსს: Ca2+ + CO32− ⇌ CaCO3 და იშლება CaCO3.
ბიკარბონატისა და წყალბადის იონების ზრდის შედეგად შემცირებული კარბონატის კონცენტრაცია ნაჩვენებია მარჯვენა გრაფიკზე.
გაჯერებულობის დონე[რედაქტირება | წყაროს რედაქტირება]
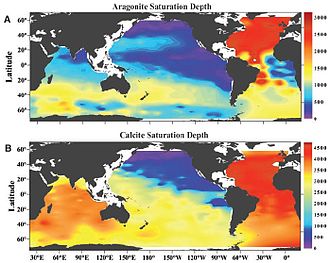
ზღვის წყლის გაჯერებულობის დონე (აღინიშნება Ω-ით) და არის მინერალის თერმოდინამიკური პოტენციალის საზომი. ქვემოთ მოყვანილია კალციუმის კარბონატის კონკრეტული მაგალითი:
Ω არის იონების კონცენტრაციის პროდუქტი, რომლებიც ქმნიან მინერალ Ca2+ სა და CO32−-ს. ნივთიერებების კონცენტრაცია იყოფა, იონების წონასწორობაზე, ანუ, როდესაც მინერალი არც ფორმირდება და არც იშლება.[37]ზღვის წყალში ბუნებრივი ჰორიზონტალური საზღვარი იქმნება ტემპერატურის, წნევისა და სიღრმის გამო და იგი ცნობილია, როგორც „გაჯერებულობის ჰორიზონტი“.[35] ამ გაჯერებულობის ჰორიზონტის ზევით, Ω- ს აქვს 1-ზე მეტი მნიშვნელობა და CaCO3 მარტივად არ იშლება. ორგანიზმების უმეტესობა, რომლებისთვისაც კალციუმის კარბონატის საფარი მნიშვნელოვანია, წყალში ცხოვრობს.[35] ამ სიღრმის ქვემოთ, Ω- ს აქვს 1-ზე ნაკლები მნიშვნელობა და აქ CaCO3 უკვე იშლება.
CO32−-ის კონცენტრაციის შემცირებისას მცირდება Ω, ანუ CaCO3-ის დაშლის რისკი უფრო მაღალია.
კალციუმის კარბონატი ძირითადად გვხვდება ორი პოლიმორფული კრისტალური სახით, ესენია არაგონიტი და კალციტი. არაგონიტი უფრო მეტად ხსნადია, ვიდრე კალციტი, ამიტომაც არაგონიტის გაჯერების ჰორიზონტი ყოველთვის უფრო ახლოს არის ზედაპირთან კალციტის გაჯერების ჰორიზონტთან შედარებით.[35] ეს ნიშნავს იმასაც, რომ ორგანიზმები, რომლებიც წარმოქმნიან არაგონიტს, უფრო დაუცველები ხდებიან იმ ორგანიზმებთან შედარებით, რომლებიც კალციტს წარმოქმნიან.[10]
გადაჭრის გზები[რედაქტირება | წყაროს რედაქტირება]
გეოინჟინერია[რედაქტირება | წყაროს რედაქტირება]
გეოინჟინერია განიხილება, როგორც მჟავიანობის თავიდან აცილების შესაძლო ვარიანტი. IAP-ს (2009 წელი)[38] განცხადებაში ნათქვამია, რომ საჭიროა უფრო მეტი გამოკვლევა ამასთან დაკავშირებით და უნდა დადგინდეს, რომ გეოინჟინერია უსაფრთხო, ხელმისაწვდომი და ღირებული იქნება.
WGBU- ს (2006 წელი),[39]დიდი ბრიტანეთის სამეფო საზოგადოებისა (2009 წელი)[40] და აშშ-ს ეროვნული სამეცნიერო საბჭოს (2011 წელი)[41] მოხსენებაში იყო გაფრთხილება კლიმატის ინჟინერიასთან დაკავშირებული პოტენციური რისკებისა და სირთულეების შესახებ.
რკინის გამოყენება[რედაქტირება | წყაროს რედაქტირება]
ამხრივ რკინის გამოყენებამ შეიძლება გამოიწვიოს ფოტოსინთეზის სტიმულირება ფიტოპლანქტონებში. რკინის ჰიპოტეზის თანახმად, ფიტოპლანქტონი გადააქცევდა ოკეანეში მოხვედრილ ნახშირორჟანგს ნახშირწყლებად და აირად ჟანგბადად, ხოლო ნახშირწყლების დიდი ნაწილი ჩაიძირებოდა ოკეანეში ღრმად. ათზე მეტმა ექსპერიმენტმა დაადასტურა, რომ ოკეანეში რკინის დამატება ფოტოსინთეზის ეფექტს ფიტოპლანქტონში 30-ჯერ ზრდის.[42]
გალერეა[რედაქტირება | წყაროს რედაქტირება]
-
ზღვის ზედაპირის pH 90-იან წლებში.
-
დღევანდელი პერიოდის ტუტიანობის მაჩვენებელი.
-
წყლის ზედაპირზე ნაჩვენებია ანთროპოგენური CO2.
-
CO32- იონების ცვალებადობა 1700-დან 1990-მდე.
-
თანამედროვე პერიოდი DIC
-
პრე-ინდუსტრიული DIC
-
CO2-ის კონცენტრაციის სენსორი, რომელიც რიფთან ახლოს ზომავას მჟავიანობას.
-
ოკეანის მჟავიანობის საზომი.
ლიტერატურა[რედაქტირება | წყაროს რედაქტირება]
- Antarctic Climate and Ecosystems Cooperative Research Centre (ACE CRC) (2008). Position analysis: CO2 emissions and climate change: Ocean impacts and adaptation issues. ISSN 1835-7911. Hobart, Tasmania.
- Doney, S. C. (2006). „The Dangers of Ocean Acidification“. Scientific American. 294 (3): 58–65. Bibcode:2006SciAm.294c..58D. doi:10.1038/scientificamerican0306-58. ISSN 0036-8733. PMID 16502612.CS1-ის მხარდაჭერა: ref=harv (link), (Article preview only).
- Drake, J.L.; Mass, T.; Falkowski, P. G. (2014). „The evolution and future of carbonate precipitation in marine invertebrates: Witnessing extinction or documenting resilience in the Anthropocene?“. Elementa. 2: 000026. doi:10.12952/journal.elementa.000026. ISSN 2325-1026.CS1-ის მხარდაჭერა: ref=harv (link)
- Feely, R. A.; Sabine, Christopher L.; Lee, Kitack; Berelson, Will; Kleypas, Joanie; Fabry, Victoria J.; Millero, Frank J. (2004). „Impact of Anthropogenic CO2 on the CaCO3 System in the Oceans“. Science. 305 (5682): 362–366. Bibcode:2004Sci...305..362F. doi:10.1126/science.1097329. PMID 15256664.CS1-ის მხარდაჭერა: ref=harv (link)
- Hand, Eric (2015). „Acid oceans cited in Earth's worst die-off“. Science. 348 (6231): 165–166. Bibcode:2015Sci...348..165H. doi:10.1126/science.348.6231.165. PMID 25859021.
- Harrould-Kolieb, E.; Savitz, J. (2008) Acid Test: Can We Save Our Oceans From CO2?. Oceana. ციტირების თარიღი: 2020-05-01. დაარქივებული 2011-10-09 საიტზე Wayback Machine.
- „Ocean acidification: the other CO2 problem“. New Scientist.com news service. 2006-08-05. დაარქივებულია ორიგინალიდან — 12 May 2008. ტექსტი „Henderson“ იგნორირებულია (დახმარება);
|first=-ს აკლია|last=(დახმარება) - Jacobson, M. Z. (2005). „Studying ocean acidification with conservative, stable numerical schemes for nonequilibrium air-ocean exchange and ocean equilibrium chemistry“. Journal of Geophysical Research: Atmospheres. 110: D07302. Bibcode:2005JGRD..11007302J. doi:10.1029/2004JD005220.CS1-ის მხარდაჭერა: ref=harv (link)
- Kim, Rakhyun E. (2012). „Is a New Multilateral Environmental Agreement on Ocean Acidification Necessary?“ (PDF). Review of European Community & International Environmental Law. 21 (3): 243–258. doi:10.1111/reel.12000.x.CS1-ის მხარდაჭერა: ref=harv (link)
- Kleypas, J. A., R. A. Feely, V. J. Fabry, C. Langdon, C. L. Sabine, and L. L. Robbins. (2006). Impacts of Ocean Acidification on Coral Reefs and Other Marine Calcifiers: A Guide for Further Research, report of a workshop held 18–20 April 2005, St. Petersburg, FL, sponsored by National Science Foundation]], NOAA and the U.S. Geological Survey, 88pp.
- Elizabeth Kolbert, E. (2006-11-20). „The Darkening Sea: Carbon emissions and the ocean“. The New Yorker.
- Mathis, J.T.; Feely, R. A. (2014). „Building an integrated coastal ocean acidification monitoring network in the U.S.“. Elementa. 1: 000007. doi:10.12952/journal.elementa.000007. ISSN 2325-1026.CS1-ის მხარდაჭერა: ref=harv (link)
- Riebesell, U., V. J. Fabry, L. Hansson and J.-P. Gattuso (Eds.). (2010). Guide to best practices for ocean acidification research and data reporting, 260 p. Luxembourg: Publications Office of the European Union.
- Stone, R. (2007). „A World Without Corals?“. Science. 316 (5825): 678–681. doi:10.1126/science.316.5825.678. PMID 17478692.CS1-ის მხარდაჭერა: ref=harv (link)
- Clarke, L. (July 2007). „Scenarios of Greenhouse Gas Emissions and Atmospheric Concentrations. Sub-report 2.1A“, რედ. U.S. Climate Change Science Program and the Subcommittee on Global Change Research: Synthesis and Assessment Product 2.1. Washington, DC., USA: Department of Energy, Office of Biological & Environmental Research.
- Good, P. (2010). An updated review of developments in climate science research since IPCC Fourth Assessment Report. London, UK: AVOID Consortium. ციტირების თარიღი: 2020-05-01. დაარქივებული 2018-09-24 საიტზე Wayback Machine. Report website.
- UK Royal Society (September 2009). Geoengineering the climate: science, governance and uncertainty. London: UK Royal Society. ISBN 978-0-85403-773-5. Report website.
- UNEP (November 2010). The Emissions Gap Report: Are the Copenhagen Accord pledges sufficient to limit global warming to 2°C or 1.5°C? A preliminary assessment. Nairobi, Kenya: United Nations Environment Programme (UNEP). ISBN 978-92-807-3134-7. ციტირების თარიღი: 2020-05-01. დაარქივებული 2011-01-24 საიტზე Archive-ItCategory:Webarchive template other archives
- US National Research Council (US NRC) (2011). America's Climate Choices. Washington, DC, USA: National Academies Press. DOI:10.17226/12781. ISBN 978-0-309-14585-5.
- WBGU (2006). Special Report: The Future Oceans – Warming Up, Rising High, Turning Sour. Berlin, Germany: German Advisory Council on Global Change (WBGU). ISBN 978-3-936191-14-1.
რესურსები ინტერნეტში[რედაქტირება | წყაროს რედაქტირება]
- Biological Impacts of Ocean Acidification (BIOACID) project
- Ocean acidification — ENCYCLOPÆDIA BRITANNICA
- Ocean Acidification — National Geographic
- What is Ocean Acidification?
- Ocean acidification
- Ocean Acidification
- The Global Problem of Ocean Acidification
- Ocean acidification and its effects
- Effects of Ocean and Coastal Acidification on Ecosystems
- What is ocean acidification?
- Ozeanversauerung - eine Bedrohung für das Leben im Meer[მკვდარი ბმული]
- bmbf.de: Wissenschaftsjahr 2016*17 – Meere und Ozeane დაარქივებული 2019-12-06 საიტზე Wayback Machine.
- Ozeanversauerung: Fakten დაარქივებული 2020-06-11 საიტზე Wayback Machine.
- Häufig gestellte Fragen: Die wichtigsten Fakten zur Ozeanversauerung. დაარქივებული 2016-03-26 საიტზე Wayback Machine.
- Luft gibt dem Ozean Saures. (PDF)
- The Acid Ocean – the Other Problem with CO2 Emission. auf: RealClimate.org
- The Ocean Acidification Network დაარქივებული 2009-12-12 საიტზე Wayback Machine.
- The Ocean in a High CO2 World. დაარქივებული 2010-07-07 საიტზე Wayback Machine.
- European Project of Ocean Acidification (EPOCA)
- Woods Hole Oceanographic Institution: Ocean Acidification.
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ Caldeira, K.; Wickett, M. E. (2003). „Anthropogenic carbon and ocean pH“. Nature. 425 (6956): 365. Bibcode:2001AGUFMOS11C0385C. doi:10.1038/425365a. PMID 14508477.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ The ocean would not become acidic even if it were to absorb the CO2 produced from the combustion of all fossil fuel resources.
- ↑ Millero, Frank J. (1995). „Thermodynamics of the carbon dioxide system in the oceans“. Geochimica et Cosmochimica Acta. 59 (4): 661–677. Bibcode:1995GeCoA..59..661M. doi:10.1016/0016-7037(94)00354-O.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ 4.0 4.1 Feely, R. A.; Sabine, C. L.; Lee, K.; Berelson, W.; Kleypas, J.; Fabry, V. J.; Millero, F. J. (July 2004). „Impact of Anthropogenic CO2 on the CaCO3 System in the Oceans“. Science. 305 (5682): 362–366. Bibcode:2004Sci...305..362F. doi:10.1126/science.1097329. PMID 15256664. ციტირების თარიღი: 2014-01-25 – წარმოდგენილია Pacific Marine Environmental Laboratory (PMEL)-ის მიერ.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ Jacobson, M. Z. (2005). „Studying ocean acidification with conservative, stable numerical schemes for nonequilibrium air-ocean exchange and ocean equilibrium chemistry“. Journal of Geophysical Research: Atmospheres. 110: D07302. Bibcode:2005JGRD..11007302J. doi:10.1029/2004JD005220.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ Hall-Spencer, J. M.; Rodolfo-Metalpa, R.; Martin, S.; et al. (July 2008). "Volcanic carbon dioxide vents show ecosystem effects of ocean acidification". Nature. 454 (7200): 96–9. Bibcode:2008Natur.454...96H. doi:10.1038/nature07051. hdl:10026.1/1345. PMID 18536730.
- ↑ Report of the Ocean Acidification and Oxygen Working Group, International Council for Science's Scientific Committee on Ocean Research (SCOR) Biological Observatories Workshop.
- ↑ Anthony, KRN; et al. (2008). „Ocean acidification causes bleaching and productivity loss in coral reef builders“. Proceedings of the National Academy of Sciences. 105 (45): 17442–17446. Bibcode:2008PNAS..10517442A. doi:10.1073/pnas.0804478105. PMID 18988740.
- ↑ Kump, L.R.; Bralower, T.J.; Ridgwell, A. (2009). „Ocean acidification in deep time“. Oceanography. 22: 94–107. doi:10.5670/oceanog.2009.10. ციტირების თარიღი: 16 May 2016.
- ↑ 10.0 10.1 10.2 Orr, James C.; et al. (2005). „Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms“ (PDF). Nature. 437 (7059): 681–686. Bibcode:2005Natur.437..681O. doi:10.1038/nature04095. PMID 16193043. დაარქივებულია ორიგინალიდან (PDF) — 25 June 2008.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ Cornelia Dean (30 January 2009). „Rising Acidity Is Threatening Food Web of Oceans, Science Panel Says“. New York Times.
- ↑ Robert E. Service (13 July 2012). „Rising Acidity Brings and Ocean Of Trouble“. Science. 337 (6091): 146–148. Bibcode:2012Sci...337..146S. doi:10.1126/science.337.6091.146. PMID 22798578.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ Zeebe, R.E. (2012). „History of Seawater Carbonate Chemistry, Atmospheric, and Ocean Acidification“. Annual Review of Earth and Planetary Sciences. 40 (1): 141–165. Bibcode:2012AREPS..40..141Z. doi:10.1146/annurev-earth-042711-105521.
- ↑ Henehan, Michael J.; Ridgwell, Andy; Thomas, Ellen; Zhang, Shuang; Alegret, Laia; Schmidt, Daniela N.; Rae, James W. B.; Witts, James D.; Landman, Neil H.; Greene, Sarah E.; Huber, Brian T. (2019-10-17). „Rapid ocean acidification and protracted Earth system recovery followed the end-Cretaceous Chicxulub impact“. Proceedings of the National Academy of Sciences. 116 (45): 22500–22504. doi:10.1073/pnas.1905989116. ISSN 0027-8424. PMID 31636204.
- ↑ Carrington, Damian (2019-10-21). „Ocean acidification can cause mass extinctions, fossils reveal“. The Guardian. ISSN 0261-3077. ციტირების თარიღი: 2019-10-22.
- ↑ Zachos, J.C.; Röhl, U.; Schellenberg, S.A.; Sluijs, A.; Hodell, D.A.; Kelly, D.C.; Thomas, E.; Nicolo, M.; Raffi, I.; Lourens, L. J.; McCarren, H.; Kroon, D. (2005). „Rapid acidification of the ocean during the Paleocene-Eocene thermal maximum“. Science. 308 (5728): 1611–1615. Bibcode:2005Sci...308.1611Z. doi:10.1126/science.1109004. PMID 15947184.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ Ocean Acidification Is Climate Change's 'Equally Evil Twin,' NOAA Chief Says. Huffington Post (9 July 2012). დაარქივებულია ორიგინალიდან — 12 July 2012. ციტირების თარიღი: 2012-07-09.
- ↑ 18.0 18.1 Nina Notman. (29 July 2014) The other carbon dioxide problem.
- ↑ Alex Rogers. (9 October 2013) Global warming's evil twin: ocean acidification.
- ↑ 20.0 20.1 Hennige, S.J. (2014). „Short-term metabolic and growth responses of the cold-water coral Lophelia pertusa to ocean acidification“. Deep-Sea Research Part II. 99: 27–35. Bibcode:2014DSRII..99...27H. doi:10.1016/j.dsr2.2013.07.005.
- ↑ Pelejero, C. (2010). „Paleo-perspectives on ocean acidification“. Trends in Ecology and Evolution. 25 (6): 332–344. doi:10.1016/j.tree.2010.02.002. PMID 20356649.
- ↑ Doney, S.C. (2009). „Ocean Acidification: The Other Problem“. Annual Review of Marine Science. 1: 169–192. Bibcode:2009ARMS....1..169D. doi:10.1146/annurev.marine.010908.163834. PMID 21141034.
- ↑ Gies, E.. (11 January 2018) Like Oceans, Freshwater Is Also Acidifying. ციტირების თარიღი: 2018-01-13
- ↑ Weiss, L. C.; Pötter, L.; Steiger, A.; Kruppert, S.; Frost, U.; Tollrian, R. (2018). „Rising pCO2 in Freshwater Ecosystems Has the Potential to Negatively Affect Predator-Induced Defenses in Daphnia“. Current Biology. 28 (2): 327–332.e3. doi:10.1016/j.cub.2017.12.022. PMID 29337079.
- ↑ carbon cycle. ციტირების თარიღი: 11 February 2010.
- ↑ Raven, J. A.; Falkowski, P. G. (1999). „Oceanic sinks for atmospheric“. Plant, Cell & Environment. 22 (6): 741–755. doi:10.1046/j.1365-3040.1999.00419.x.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ Cramer, W.; et al. (2001). „Global response of terrestrial ecosystem structure and function to and climate change: results from six dynamic global vegetation models“. Global Change Biology. 7 (4): 357–373. Bibcode:2001GCBio...7..357C. doi:10.1046/j.1365-2486.2001.00383.x.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ Kump, Lee R.; Kasting, James F.; Crane, Robert G. (2003) The Earth System, 2nd, Upper Saddle River: Prentice Hall, გვ. 162–164. ISBN 978-0-613-91814-5.
- ↑ IPCC (2005). „IPCC Special Report on Carbon Dioxide Capture and Storage“ (PDF): 390. დაარქივებულია ორიგინალიდან (PDF) — 10 February 2010. ციტირების თარიღი: 1 November 2014. მითითებულია ერთზე მეტი
|archiveurl=და|archive-url=(დახმარება); მითითებულია ერთზე მეტი|archivedate=და|archive-date=(დახმარება); დამოწმება journal საჭიროებს|journal=-ს (დახმარება); მითითებულია ერთზე მეტი|accessdate=და|access-date=(დახმარება) - ↑ Ocean Acidification. დაარქივებულია ორიგინალიდან — 2020-05-08. ციტირების თარიღი: 2020-05-02.
- ↑ Mora, C (2013). „The projected timing of climate departure from recent variability“. Nature. 502 (7470): 183–187. Bibcode:2013Natur.502..183M. doi:10.1038/nature12540. PMID 24108050. ციტატა: „Global mean ocean pH moved outside its historical variability by 2008 (±3 years s.d.), regardless of the emissions scenario analysed“
- ↑ Bows, Kevin; Bows, Alice (2011). „Beyond 'dangerous' climate change: emission scenarios for a new world“. Philosophical Transactions of the Royal Society A. 369 (1934): 20–44. Bibcode:2011RSPTA.369...20A. doi:10.1098/rsta.2010.0290. PMID 21115511.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ Turley, C. (2008). „Impacts of changing ocean chemistry in a high-CO2 world“. Mineralogical Magazine. 72 (1): 359–362. Bibcode:2008MinM...72..359T. doi:10.1180/minmag.2008.072.1.359.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ 34.0 34.1 Feely, R. A.; Sabine, C. L.; Hernandez-Ayon, J. M.; Ianson, D.; Hales, B. (June 2008). „Evidence for upwelling of corrosive "acidified" water onto the continental shelf“. Science. 320 (5882): 1490–2. Bibcode:2008Sci...320.1490F. CiteSeerX 10.1.1.328.3181. doi:10.1126/science.1155676. PMID 18497259. ციტირების თარიღი: 2014-01-25 – წარმოდგენილია Pacific Marine Environmental Laboratory (PMEL)-ის მიერ.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ 35.0 35.1 35.2 35.3 Raven, JA, et al. (2005) "Ocean acidification due to increasing atmospheric carbon dioxide". Royal Society, London, UK.
- ↑ Mitchell, M. J.; et al. (2010). „A model of carbon dioxide dissolution and mineral carbonation kinetics“. Proceedings of the Royal Society A. 466 (2117): 1265–1290. Bibcode:2010RSPSA.466.1265M. doi:10.1098/rspa.2009.0349.
- ↑ Atkinson, M.J.; Cuet, P. (2008). „Possible effects of ocean acidification on coral reef biogeochemistry: topics for research“. Marine Ecology Progress Series. 373: 249–256. Bibcode:2008MEPS..373..249A. doi:10.3354/meps07867.CS1-ის მხარდაჭერა: ref=harv (link)
- ↑ IAP. (June 2009) Interacademy Panel (IAP) Member Academies Statement on Ocean Acidification. დაარქივებულია ორიგინალიდან — 2013-08-06. ციტირების თარიღი: 2020-05-02., Secretariat: TWAS (the Academy of Sciences for the Developing World), Trieste, Italy.
- ↑ WBGU (2006), Summary for Policymakers, Halting ocean acidification in time, p. 3
- ↑ UK Royal Society (2009), Summary, pp. ix–xii.
- ↑ US NRC (2011), Ch 5: Key Elements of America's Climate Choices,Box 5.1: Geoengineering, pp. 52–53.
- ↑ Trujillo, Alan (2011). Essentials of Oceanography. Pearson Education, Inc., გვ. 157. ISBN 9780321668127.

![{\displaystyle {\Omega }={\frac {\left[{\ce {Ca^2+}}\right]\left[{\ce {CO3^2-}}\right]}{K_{sp}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0422ec8bbb280ae8547a20d486b928b0c21846f4)