ამიაკი
| ამიაკი | |
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | ამიაკი |
| ქიმიური ფორმულა | NH3 |
| მოლური მასა | 17.031 გ/მოლი |
| თერმული თვისებები | |
| დნობის ტემპერატურა | −77.73 °C |
| დუღილის ტემპერატურა | −33.34 °C |
| სტრუქტურა | |
| დიპოლური მომენტი | 1.42 დ |
| კლასიფიკაცია | |
| CAS | 7664-41-7 |
| PubChem | 222 |
| SMILES |
|
| RTECS | BO0875000 |
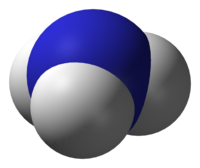
ამიაკი — ქიმიური ნივთიერება, მისი ფორმულაა NH3. ნორმალურ პირობებში (ნ.პ.) უფერო აირია, მკვეთრი დამახასიათებელი სუნით. ამიაკის სიმკვრივე თითქმის ორჯერ ნაკლებია ჰაერისაზე.
ამიაკის ერთი მოლეკულა სამკუთხა პირამიდას წარმოადგენს, რომლის წვერშიც აზოტი მდებარეობს.
ამიაკის მოლეკულები −77.73°C ტემპერატურაზე დნობას, ხოლო −33.34°C დუღილს იწყებენ.
2014 წელს გლობალურ ინდუსტრიაში 176 300 000 ტონა [1] ამიაკი აწარმოეს, რაც 16%-ით მეტია 2006 წლის მაჩვენებელზე (152 000 000 ტონა[2]).
ამიაკი სუფთა სახით 1774 წელს ჯოზეფ პრისტლიმ აღმოაჩინა და „ტუტე ჰაერი“ (ინგლ. alkaline air) უწოდა[3]. 11 წლის შემდეგ კი 1785 წელს კლოდ ლუი ბერტოლმა მისი ზუსტი ქიმიური შედგენილობა დაადგინა.[4]
ლიტერატურა[რედაქტირება | წყაროს რედაქტირება]
- (1986) რედ. Bretherick, L.: Hazards in the Chemical Laboratory, 4th, London: Royal Society of Chemistry. ISBN 0-85186-489-9. OCLC 16985764.
რესურსები ინტერნეტში[რედაქტირება | წყაროს რედაქტირება]

ვიკისაწყობში არის გვერდი თემაზე:
- ამიაკი, უცხო სიტყვათა ლექსიკონი www.nplg.gov.ge
- International Chemical Safety Card 0414 (anhydrous ammonia), ilo.org.
- International Chemical Safety Card 0215 (aqueous solutions), ilo.org.
- Ammoniac et solutions aqueuses fr. Institut National de Recherche et de Sécurité. დაარქივებულია ორიგინალიდან — 2010-12-11. ციტირების თარიღი: 2016-07-22.
- Emergency Response to Ammonia Fertilizer Releases (Spills) for the Minnesota Department of Agriculture.ammoniaspills.org
- National Institute for Occupational Safety and Health – Ammonia Page, cdc.gov
- NIOSH Pocket Guide to Chemical Hazards - Ammonia, cdc.gov
- Ammonia, video დაარქივებული 2015-10-30 საიტზე Wayback Machine.
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ pg. 119 – Nitrogen (PDF). USGS (2016). ციტირების თარიღი: 17 February 2016.
- ↑ Nitrogen (PDF). USGS (2016). ციტირების თარიღი: 17 February 2016.
- ↑ Priestley, Joseph (1775). „Observations on Alkaline Air“, Experiments and Observations on Different Kinds of Air, Second edition, გვ. 163-177.
- ↑ Berthollet (1788). „Analyse de'l Alkali volatil“. Histoire de l'Académie Royale des Sciences. Année M. DCCLXXXV. Avec les Mémoires de Mathématique & de Physique pour la même Année: 316–326.
