COVID-19-ის ვაქცინა


COVID‑19-ის ვაქცინა ― ვაქცინა, რომლის მიზანია შეძენილი იმუნიტეტის გამომუშავება მწვავე რესპირატორული სინდრომის კორონავირუსის (SARS‑CoV‑2), კორონავურუსული დაავადება 2019-ის (COVID‑19) გამომწვევი ვირუსის წინააღმდეგ. COVID-19-ის პანდემიამდე არსებობდა ცოდნა იმ კორონავირუსების აგებულებისა და ფუნქციების შესახებ, რომელთაც გამოიწვიეს მწვავე რესპირატორული სინდრომი (SARS) და ახლო აღმოსავლეთის რესპირატორული სინდრომი (Middle East respiratory syndrome, MERS). ამ ცოდნამ დააჩქარა ვაქცინების რამდენიმე ტექნოლოგიის შექმნა 2020 წლის დასაწყისში.[1] SARS-CoV-2-ის საწინააღმდეგო ვაქცინები თავდაპირველად ორიენტირებული იყო სიმპტომატური, ხშირად მწვავედ მიმდინარე ავადმყოფობის თავიდან აცილებაზე.[2] 2020 წლის 10 იანვარს პლატფორმა GISAID-ის საშუალებით გავრცელდა SARS-CoV-2-ის გენეტიკური კვლევის შედეგები და მისი გენეტიკური მიმდევრობა, ხოლო 19 მარტისთვის მსოფლიო ფარმაცევტული ინდუსტრია COVID-19-ის წინააღმდეგ ბრძოლაში ერთობლივი ძალისხმევით ჩაერთო.[3] ვაქცინების როლი COVID‑19-ის გავრცელების, სიმწვავისა და სიკვდილიანობის შემცირებაში ფართოდაა აღიარებული.[4]
კლინიკური კვლევის III მესამე ფაზაში ზოგიერთმა ვაქცინამ 95%-მდე ეფექტიანობა აჩვენა სიმპტომური ინფექციის თავიდან აცილების კუთხით. ამ დროისათვის არსებობს 20 ვაქცინა, რომელიც საზოგადო გამოყენებისთვის ავტორიზებული სულ მცირე ერთი ეროვნული რეგულატორის მიერ: ორი რნმ ვაქცინა (Pfizer–BioNTech და Moderna), ცხრა კონვენციური ინაქტივირებული ვაქცინა (BBIBP-CorV, იგივე სინოფარმი, ჩინეთის სამედიცინო მეცნიერებათა აკადემიის ვაქცინა, CoronaVac, იგივე სინოვაკი, Covaxin, CoviVac (რუსული COVID-19-ის ვაქცინა, COVIran Barakat, Minhai-Kangtai, QazVac და WIBP-CorV), ხუთი ვექტორული ვაქცინა (Sputnik Light, Sputnik V, Oxford–AstraZeneca, Convidecia და Janssen, მწარმოებელი Johnson & Johnson), ოთხი სუბიუნიტური ვაქცინა (Abdala, EpiVacCorona, MVC-COV1901, Soberana 02 და ZF2001).[5][6] მთლიანობაში, განვითარების სხვადასხვა ეტაპზეა ვაქცინის 330 კანდიდატი, მათ შორის, 102 არის კლინიკური კვლევების ეტაპზე, რომელთაგანაც 30 I, 30 I–II, 25 III, ხოლო 8 IV ფაზის ცდებს გადის.[5]
ბევრმა ქვეყანამ ვაქცინების განაწილების ფაზირებული სისტემა გამოიყება, რის შედეგადაც მოხდა პრიორიტეტული, გართულებების ან გადადების მაღალი რისკის ჯგუფების გამოვლენა და ვაქცინაცია, როგორიცა მოხუცები და ჯანდაცვის მუშაკები.[7] განიხილება შუალედური, ერთდოზიანი ვაქცინაციის გამოყენებაც, ვიდრე ვაქცინების ხელმისაწვდომობა არ გაუმჯობესდება.[8][9][10][11]
სხვადასხვა ქვეყნების ჯანდაცვის სააგენტოების მონაცემების მიხედვით, 2021 წლის 2 ოქტომბრისთვის მსოფლიოს მასშტაბით გაკეთებული იყო COVID‑19-ის ვაქცინის 6.31 მილიარდი დოზა.[12] AstraZeneca 2021 წლის ბოლომდე 3 მილიარდი დოზის გამოშვებას გეგმავს, Pfizer–BioNTech 1.3 მილიარდი დოზისა, ხოლო Sputnik V, Sinopharm, Sinovac და Janssen თითოეული 1 მილიარდი დოზის; Moderna 600 მილიონი დოზის გამოშვებას გეგმავს, ხოლო Convidecia 500 მილიონისა.[13][14] 2020 წლის დეკემბრისთვის სხვადასხვა ქვეყნებმა ვქცინების 10 მილიარდზე მეტი დოზა შეუკვეთეს,[15] რისი ნახევარიც მოდიოდა მაღალშემოსავლიან ქვეყნებზე, რომლებიც მსოფლიოს მოსახლეობის დაახლოებით 14%-ს წარმოადგენენ.[16]
ფონი[რედაქტირება | წყაროს რედაქტირება]


COVID‑19-ის პანდემიამდე ინფექციური დაავადების წინააღმდეგ ვაქცინა არასოდეს შექმნილა რამდენიმე წელზე უფრო მოკლე პერიოდში, ხოლო ადამიანებში კორონავირუსული ინფექციების წინააღმდეგ ვაქცინა არ არსებობდა.[17] თუმცა, არსებობდა ვაქცინები კორონავირუსებით გამოწვეული დაავადებების წინააღმდეგ ცხოველებში, მათ შორის, უკვე 2003 წელს, ფრინველის ინფექციური ბრონქიტის, ძაღლების კორონავირუსის და კატისებრთა კორონავირუსის წინააღმდეგ.[18] არსებობდა პროექტები SARS და MERS-ის გამომწვევი, კორონავირუსების ოჯახში (Coronaviridae) შემავალი ვირუსების წინააღმდეგ ვაქცინების შემუშავებასთან დაკავშირებით. ვაქცინები SARS-ის[19] და MERS-ის[20] წინააღმდეგ ცხოველებზეც იყო გამოცდილი.
2005 და 2006 წლებში გამოქვეყნებული კვლევების მიხედვით, SARS-ის წინააღმდეგ და მის სამკურნალოდ ახალი ვაქცინებისა და პრეპარატების შექმნა იმ დროს მთავრობებისა და ჯანდაცვის სააგენტოების პრიორიტეტს წარმოადგენდა მსოფლიოს მასშტაბით.[21][22][23] როგორც SARS-ის,[24][25] ისე MERS-ის[26] წინააღმდეგ ადამიანებისთვის ეფექტური ვაქცინა ამჟამად არ არსებობს. MERS-ის გავრცელებისას არსებობდა მოსაზრება, რომ SARS-ზე ჩატარებული კვლევები მნიშვნელოვანი საფუძველი იქნებოდა MERS-CoV ინფექციის წინააღმდეგ ეფექტური ვაქცინისა და თერაპიული საშუალებების შექმნისათვის.[24][27] 2020 წლის მარტისთვის არსებობდა MERS-ის ერთი, დნმ-ზე დაფუძნებული ვაქცინა, რომელიც I ფაზის კლინიკურ ცდებს გადიოდა ადამიანებზე,[28] ხოლო სხვა სამი, ვექტორული ტიპის ვაქცინა, ორი ადენოვირულ-ვექტორული (ChAdOx1-MERS, BVRS-GamVac) და ერთი MVA-ვექტორული (MVA-MERS-S) დამუშავების სტადიაში იყო.[29]
ვაქცინის ტიპები[რედაქტირება | წყაროს რედაქტირება]
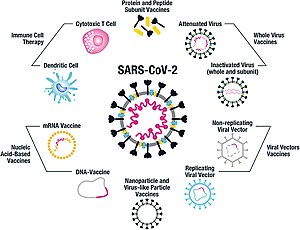
COVID‑19-ის ეფექტური ვაქცინის შესაქმნელად მუშავდება და კვლევის საგანია სულ მცირე ცხრა სხვადასხვა ტექნოლოგიური პლატფორმა.[5][31] ვაქცინის კანდიდატების პლატფორმათა უმეტესობა ფოკუსირებულია კორონავირუსის სპაიკ-პროტეინზე და მის ვარიანტებზე, როგორც COVID‑19-ის ინფექციის მთავარ ანტიგენზე.[31] 2020 წლის განმავლობაში შექმნილი პლატფორმები მოიცავს ინფორმაციულ რნმ-ს (mRNA) და დნმ-ს შეცვლილი ნუკლეოზიდებით, რეპლიკაციის უნარის არმქონე ვირუსულ ვექტორებს, პეპტიდებს, რეკომბინანტ პროტეინებს, ცოცხალ დასუსტებულ ვირუსებს და ინაქტივირებულ ვირუსებს.[17][31][32][33]
COVID‑19-ის ბევრი ვაქცინის ტექნოლოგია არ ჰგავს უკვე არსებულ ვაქცინებს, რომლებსაც გრიპის წინააღმდეგ იყენებენ, არამედ, მათში გამოყენებული „ახალი თაობის“ სტრატეგიები, რომლებიც უფრო ზუსტადაა გამიზნული COVID‑19-ის ინფექციის კონკრეტულ მექანიზმებზე.[31][32][33] რამდენიმე სინთეტური ვაქცინა იყენებს 2P მუტაციას, რომელიც კეტავს სპაიკ-პროტეინს შეერთებამდელ მდგომარეობაში, რაც იწვევს იმუნურ რეაქციას ვირუსზე მანამდე, სანამ ვირუსი ადამიანის უჯრედს შეუერთდება.[34] ვაქცინის პლატფორმებმა, შესაძლოა, გააუმჯობესოს მოქნილობა ანტიგენების მანიპულირებაში და შესაძლებელი გახადოს COVID‑19-ის ინფექციის მექანიზმებზე უფრო ზუსტი გამიზვნა პოპულაციის მოწყვლად ქვეჯგუფებში, როგორიცაა ჯანდაცვის მუშაკები, მოხუცები, ბავშვები, ორსული ქალები და სუსტი იმუნური სისტემის მქონე ადამიანები.[31][32]
რნმ ვაქცინები[რედაქტირება | წყაროს რედაქტირება]

რნმ ვაქცინა შეიცავს რიბონუკლეინის მჟავას, რომელსაც, ორგანიზმში მოხვედრისას, უჯრედს აწვდის ინფორმაციას, რის შედეგადაც უჯრედში ხდებ ორგანიზმისთვის უცხო პროტეინის სინთეზირება. ეს იწვევს ადაპტიურ იმუნურ რეაქციას, რის შედეგადაც ორგანიზმი სწავლობს, თუ როგორ ამოიცნოს და გაანადგუროს მსგავსი პათოგენები ან სიმსივნური უჯრედები. რნმ ვაქცინებში ხშირად, მაგრამ არა ყოველთვის, გამოყენებულია ინფორმაციული რნმ შეცვლილი ნუკლეოზიდებით. ორგანიზმში ამ რნმ-ის შეყვანისთვის მის მოლეკულას ათავსებენ ლიპიდურ ნანონაწილაკებში, რომელიც იცავს რნმ-ის ჯაჭვს და ხელს უწყობს უჯრედის მიერ მის შეწოვას.[35][36][37][38]
რნმ ვაქცინები COVID‑19-ის პირველი ვაქცინები იყო, რომელთაც დიდ ბრიტანეთში, შეერთებულ შტატებსა და ევროკაშირის ქვეყნებში ავტორიზაცია მიიღეს.[39][40] ამჟამად რნმ ტიპის ავტორიზებული ვაქცინებია Pfizer–BioNTech
რნმ ვაქცინებზე მწვავე ალერგიული რეაქცია ძალზე იშვიათია. 2020 წლის დეკემბრისთვის Pfizer–BioNTech-ის 1,893,360 პირველი დოზა იყო გაკეთებული, ხოლო მათგან მწვავე ალერგიული რეაქცია მხოლოდ 175 შემთხვევაში დაფიქსირდა, აქედან მხოლოდ 21 იყო ანაფილაქსიური ხასიათის.[47] Moderna-ს 4,041,396 დოზიდან, რომელიც 2020 წლის დეკემბერში და 2021 წლის იანვარში გაკეთდა, მწვავე ალერგიული რეაქცია მხოლოდ 10 შემთხვევაში გამოვლინდა.[47] ალერგიული რეაქციის ყველაზე სავარაუდო გამომწვევი ლიპიდური ნანონაწილაკებია.[47]
ადენოვირუსული ვექტორული ვაქცინები[რედაქტირება | წყაროს რედაქტირება]
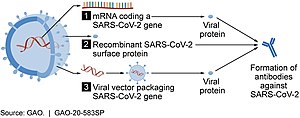
აღნიშნული ვაქცინები რეპლიკაციის უნარის არმქონე ვირუსულ ვექტორებს იყენებს, კერძოდ, ადენოვირუსის გარსს, რომელიც შეიცავს SARS‑CoV‑2-ის პროტეინის დნმ-ს.[48][49] COVID‑19-ის ვექტორულ ვაქცინებში გამოყენებულ ვირუსებს რეპლიკაციის უნარი დაკარგული აქვს, რაც ნიშნავს, რომ მათ ახალი ვირუსების წარმოქმნა არ შეუძლიათ, არამედ, წარმოქმნიან მხოლოდ ანტიგენს, რომელიც ორგანიზმში სისტემურ იმუნურ რეაქციას იწვევს.[48]
ავტორიზებული ვექტორული ვაქცინებია Oxford–AstraZeneca,
Convidecia და Janssen ერთდოზიანი ვაქცინებია. მათი ლოგისტიკური უზრუნველყოფა შედარებიტ მარტივია და მათი შენახვა ჩვეულებრივ მაცივრებშიც რამდენიმე თვის განმავლობაშია შესაძლებელი.[56][57]
Sputnik V პირველი დოზისთვის Ad26-ს იყენებს, რომელიც Janssen-ის ერთი დოზის იდენტურია, ხოლო მეორე დოზისთვის Ad5-ს, რომელიც Convidecia-ს ერთი დოზის იდენტურია.[58]
2021 წლის 11 აგვისტოს, ვირუსის დელტა ვარიანტის გავრცელების გამო, Sputnik V-ის მწარმოებელმა Pfizer-ს შესთავაზა, ჩაეტარებინა ცდები mRNA ვაქცინის შემდეგ Ad26 კომპონენტის (ე.წ. „Sputnik Light-ის“) ბუსტერად გამოყენებაზე.[59]
ინაქტივირებული ვაქცინები[რედაქტირება | წყაროს რედაქტირება]
ინაქტივირებული ვაქცინები შედგება ვირუსული ნაწილაკებისგან, რომლებიც გაზრდილია ლაბორატორიულ პირობებში (მიკრობიოლოგიური კულტურის სახით) და შემდეგ მოკლულია სხვადასხვა მეთოდით, როგორიცაა მაღალი ტემპერატურა ან ფორმალდეჰიდი, რის შედეგადაც ისინი კარგავენ ავადმყოფობის გამომწვევ თვისებებს, მაგრამ შეუძლიათ ორგანიზმსი იმუნური რეაქციის სტიმულირება.[60]
ამ ტიპის ავტორიზებული ვაქცინებია ჩინური CoronaVac (იგივე „სინოვაკი“),[61][62][63] BBIBP-CorV (იგივე „სინოფარმი“),
სუბიუნიტური ვაქცინები[რედაქტირება | წყაროს რედაქტირება]
სუბიუნიტური ვაქცინებს ორგანიზმში შეჰყავს ერთი ან რამდენიმე ანტიგენი (ქვეერთეული) პათოგენის მთლიანი ნაწილაკების ნაცვლად. გამოყენებული ანტიგენები უმეტესწილად პროტეინული ქვეერთეულებია, თუმცა, შესაძლებელია ნებისმიერი მოლეკულის გამოყენება, რომელიც პათოგენის ფრაგმენტს წარმოადგენს.[69]
ამჟამად ავტორიზებულია პეპტიდური ვაქცინები EpiVacCorona (რუსეთი)
კლინიკურ ცდებს გადიოდა ავსტრალიური წარმოების V451, თუმცა, ცდები შეწყდა, რადგან აღმოჩნდა, რომ V451-ით ვაქცინირებულ პირებში HIV ტესტირება მცდარ შედეგებს იძლეოდა.
სხვა ტიპის ვაქცინები[რედაქტირება | წყაროს რედაქტირება]
ვაქცინის სხვა ტიპები, რომლებიც კლინიკურ ცდებს გადის, მოიცავს ვირუსისებრი ნაწილაკების ვაქცინებს, რამდნიმე დნმ ვაქცინას,[74]
ორალური და ინტრანაზალური გზით მისაღები ვაქცინები კვლევის და ჩამოყალიბების ეტაპზეა.[83]
ჩატარებულია კვლევები, თუ რამდენად იწვევს სხვა დაავადებებისათვის განკუთვნილი ვაქცინები იმუნური სისტემის მომზადებას, რამაც, შესაძლოა, შეამსუბუქოს COVID‑19-ის მიმდინარეობა.[84] არსებობს ექსპერიმენტული მონაცემები, რომ ტუბერკულოზის საწინააღმდეგო BCG ვაქცინას იმუნურ სისტემაზე ზოგადი ეფექტი გააჩნია, თუმცა, არ არსებობს მტკიცებულება, რომ იგი ეფექტურია COVID‑19-ის წინააღმდეგ.[85]
ფორმულირება[რედაქტირება | წყაროს რედაქტირება]
2020 წლის სექტემბრისთვის ვაქცინის 11 კანდიდატი იმუნოგენურობის გასაზრდელად იყენებდა ადიუვანტებს.[31] იმუნოლოგიური ადიუვანტი წარმოადგენს ვაქცინაში შემავალ ნივთიერებას, რომელიც ზრდის ორგანიზმის იმუნურ რეაქციას ანტიგენზე, როგორიცაა COVID‑19-ის ან გრიპის ვირუსი.[86] შედეგად, ძლიერდება იმუნოგენურობა და მცირდება COVID‑19-ის ინფექციის გადადების შანსი ან მისი სიმწვავე აცრილებში.[86][87] COVID‑19-ის ვაქცინებში შემავალი ადიუვანტები, შესაძლოა, განსაკუთრებით ეფექტური იყოს ინაქტივირებულ და ვაქტორულ ტექნოლოგიებზე დაფუძნებულ ვაქცინებში.[87] ლიცენზირებულ ვაქცინებში გამოყენებული პირველი ადიუვანტები ალუმინის მარილები (ე.წ. „ალუმი“) იყო. ატორიზებული ვაქცინების 80% სწორედ ამ ადიუვანტებს იყენებს.[87] ალუმის ადიუვანტი ორგანიზმში იმუნოგენურობის გასაძლიერებლად სხვადასხვა მოლეკულურ და უჯრედულ მექანიზმებს ააქტიურებს, როგორიცაა, მაგალითად, ანთებითი ციტოკინების გამოყოფა.[86][87]
დაგეგმარება და განვითარება[რედაქტირება | წყაროს რედაქტირება]
2020 წლის იანვრიდან მოყოლებული ვაქცინის განვითარება დააჩქარა საერთაშორისო ფარმაცევტული ინდუსტრიის და სახელმწიფოთა მთავრობების უპრეცედენტო კოლაბორაციამ.[31]
ვაქცინის შექმნის და დამუშავების მთლიან პერიოდში ხდება რამდენიმე საფეხურის შეფასება, მათ შორისა:[17][88]
- ვაქცინის ტოქსიკურობის მისაღები დონე (მისი უსაფრთხოება),
- მოწყვლადი სამიზნე პოპულაციების განსაზღვრა,
- ვაქცინაციით უზრუნველყოფილი დაცვის ხანგრძლივობა,
- ვაქცინირების სპეციალური სისტემები (ორალური ან ნაზალური ნაცვლად ინექციისა),
- დოზირების რეჟიმები,
- სტაბილურობა და შენახვის პირობები,
- გადაუდებელი გამოყენების ავტორიზაცია ფორმალური ლიცენზირების მოპოვებამდე,
- ოპტიმალური წარმოება მილიარდობით დოზის მასშტაბების მისაღწევად,
- ლიცენზირებული ვაქცინების განაწილება და დისტრიბუცია.
გამოწვევები[რედაქტირება | წყაროს რედაქტირება]
COVID‑19-ის ვაქცინის განვითარებას რამდენიმე უნიკალური გამოწვევა ახლდა თან.
ვაქცინის შექმნის სასწრაფო და გადაუდებელმა საჭიროებამ ვაქცინის შექმნის დროის შეკუმშვა გამოიწვია, ზოგიერთ შემთხვევაში კლინიკური ცდების სხვადასხვა საფეხურები კომბინირებულად, რამდენიმე თვიან პერიოდში განხორციელდა, მაშინ, როცა ეს პროცესი თანმიმდევრობით, რამდენიმე წლის განმავლობაში ხორციელდება ხოლმე.[89]
აღნიშნული პროცესი მოიცავს უსაფრთხოების, ეფექტიანობის და დოზირების ცდებს, რომლებიც COVID‑19-ის ვაქცინის შემთხვევაში კომბინირებულად, რამდენიმე თვის განმავლობაში ჩატარდა, რასაც, პოტენციურად, ვაქცინის უსაფრთხოებაზე უარყოფითი გავლენის მოხდება შეუძლია.[89][90] მგალიტად, ვაქცინის ჩინურმა მწარმოებლებმა და ჩინეთის დაავადებათა კონტროლისა და პრევენციის ცენტრმა ვაქცინაზე მუშაობა 2020 წლის იანვარში დაიწყეს,[91] მარტში კი უკვე ვაქცინის რამდენიმე კანდიდატს განიხილავდნენ, მიზანი კი ამერიკის შეერთებულ შტატებთან შედარებით ჩინეთის ტექნოლოგიური სიძლიერის დემონსტრირება და ჩინელი ხალხის დარწმუნება იყო სამამულო წარმოების ვაქცინების ხარისხიანობაში.[89][92]
ვაქცინების წარმოების გადაუდებელმა საჭიროებამ და მათი დამუშავების დაჩქარებამ შეიძლება რისკის წინაშე დააყენოს უსაფრთხო, ეფექტური ვაქცინის შექმნა.[32][33][93] გარდა ამისა, უნივერსიტეტებში კვლევით პროცესებს აფერხებს ფიზიკური დისტანცირება და ლაბორატორიების დახურვა.[94][95]
ვაქცინის კანდიდატმა კლინიკური ცდების რამდენიმე ფაზა უნდა გაიაროს უსაფრთხოების, იმუნოგენურობის, ეფექტურობის, დოზირების და გვერდითი ეფექტების კვლევისათვის. [96][97] ვაქცინების შემქმნელებმა ინვესტიციები უნდა განახორციელონ საერთაშორისო მასშტაბით II–III ფაზებისთვის საკმარისი მონაწილეების მოსაძებნად, რაშიც სხვა კომპანიების კონკურენაციასაც აწყდებიან ხოლმე.[98] კლინიკური ცდების ორგანიზატორები შეიძლება წააწყდნენ ხალხის წინააღმდეგობასაც, რომელთაც არ სურთ ვაქცინის გაკეთება სხვადასხვა მიზეზით,[99] როგორიცაა ყოყმანი, უნდობლობა ვაქცინის წარმოების ტექნოლოგიის მეცნიერული მეთოდის ან მისი ეფექტურობის მიმართ.[100] პანდემიის დროს ახალი ვაქცინების შექმნასთან ერთად ლიცენზირების პროცედურები კომპანიებისგან შექმნასა დ წარმოებაზე სრული დოსიეს მიწოდებას გულისხმობს.[101][102][103]
ორგანიზაციები[რედაქტირება | წყაროს რედაქტირება]
2020 წლის აპრილში დიდმა ოცეულმა და მსოფლიოს ჯანდაცვის ორგანიზაციამ გამოაცხადეს ინიციატივა სახელწოდებით „COVID-19-ის ხელსაწყოებზე წვდომის ამაჩქარებელი“ (ინგლ. Access to COVID-19 Tools Accelerator, ACT-A).[104][105] იგი წარმოადგენს ინტერდისციპლინარულ მხარდამჭერ სტრუქტურას, რომელიც საშუალებას აძლევს პარტნიორ ქვეყებსა და ორგანიზაციებს, ერთმანეთს გაუზიარონ ცოდნა და რესურსები. ACT-A ოთხი პლატფორმისგან შედგება, რომელთაგანაც თითოეულს ორი ან სამი პარტნიორი მართავს: ვაქცინები (ე.წ. COVAX პლატფორმა), დიაგნოსტიკა, თერაპიები და ჯანდაცვის სისტემების მაკავშირებელი.[106] ჯანმომ 2020 წლის აპრილში გამოსც „კვლევისა და განვითარების გეგმა ახალი კორონავირუსისთვის“ (R&D Blueprint (for the) novel Coronavirus), რომელშიც გაწერილია „ფართო, საერთაშორისო, მრავალ ადგილას მიმდინარე, ინდივიდუალურად შემთხვევითი კონტროლირებული კლინიკური კვლევა“, რომლის საშუალებითაც შესაძლებელია „ვაქცინის თითოეული სავარაუდო კანდიდატთან დაკავშირებული სარგებლისა და რისკების ერთდროული შეფასება ცდებისთვის მათი მზადყოფნიდან 3-6 თვეში“. ჯანმოს ვაქცინების კოალიცია ადგენს პრიორიტეტებს, თუ რომელი ვაქცინა გადავა კლინიკური ცდების II და III ფაზაზე, ხოლო III ფაზაზე გადასული კანდიდატებისთვის ცდების ჰარმონიზებულ პროტოკოლებს გამოსცემს.[107]
ვაქცინების შექმნაში ჩართული იყვნენ სახელმწიფოთა მთავრობებიც. კანადამ ვაქცინებთან დაკავშირებული 96 კვლევითი პროექტი დააფინანსა კანადურ კომპანიებსა და უნივერსიტეტებში. პროექტის გეგმებში შედიოდა „ვაქცინების ბანკის“ შექმნა, რომლის გამოყენებაც სხვა კორონავირუსული აფეთქებების დროსაც შეიძლება მომავალში,[108] ასევე, კლინიკური ცდების მხარდაჭერა და ვაქცინების წარმოებისა და მიწოდების ჯაჭვების განვითარება.[109]
ჩინეთის მთავრობამ ვაქცინების ერთ-ერთი მწარმოებელი დაბალპროცენტიანი სესხით უზრუნველჰყო, ასევე, სწრაფად გამოუყო მიწა ქარხნების ასაშენებლად.[90] ვაქცინების ადგილობრივ მწარმოებელს ჩინეთის მთავრობა მხარს უჭერს კვლევების, კლინიკური ცდების და წარმოების პროცესის დაფინანსებაში.[110]
დიდმა ბრიტანეთმა 2020 წლის აპრილში COVID‑19-ის ვაქცინის საკითხზე სამუშაოდ სპეციალური ჯგუფი შექმნა, რომელსაც ინდუსტრიის, უნივერსიტეტების და სამთავრობო სააგენტოების თანამშრომლობის გზით ვაქცინის შექმნის სტიმულირება დაევალა, რაც ვაქცინის შექმნიდან წარმოებამდე ყველა ფაზას მოიცავდა.[111]
ამერიკის შეერთებულ შტატებში მოწინავე ბიოსამედიცინო კვლევების და განვითარების სააგენტომ (Biomedical Advanced Research and Development Authority, BARDA), ფედერალურმა უწყებამ, რომელიც დაავადებებთან ბრძოლის ტექნოლოგიებს აფინანსებს, გამოაცხადა მზადყოფნა COVID‑19-ის ამერიკული ვაქცინების შექმნის და ყველაზე სავარაუდო კანდიდატების წარმოების ფინანსური მხარდაჭერის შესახებ.[90][112] 2020 წლის მაისში მთავრობამ ამ მიზნით დაიწყო დაფინანსება პროგრამისა Operation Warp Speed.[113][114] 2021 წლის მარტისთვის BARDA-ს COVID-19-ის ვაქცინის შექმნისთვის დაახლოებით 19.3 მილიარდი დოლარის ინვესტიცია ჰქონდა გაკეთებული.[115]
დიდმა ფარმაცევტულმა კომპანიებმა ვაქცინების მასიური წარმოების გამოცდილებით, როგორიცაა Johnson & Johnson, AstraZeneca და GlaxoSmithKline (GSK), შექმნეს ალიანსები ბიოტექნოლოგიურ კომპანიებთან, მთავრობებთან და უნივერსიტეტებთან ეფექტური ვაქცინების შექმნის დაჩქარების მიზნით.[90][89]
ისტორია[რედაქტირება | წყაროს რედაქტირება]

2019 წლის ბოლოს მოხდა COVID-19-ის ინფექციის გამომწვევი ვირუსის, SARS-CoV-2-ის იზოლირება,[116] 2020 წლის 11 იანვარს კი მისი გენეტიკური სეკვენციაც გამოქვეყნდა, რასაც მოჰყვა დაუყოვნებელი საერთაშორისო რეაქცია შესაძლო პანდემიისთვის მომზადების და პრევენციული ვაქცინის შექმნის მიზნით.[32][117][118] პროცესი დააჩქარა ფარმაცევტული ინდუსტრიის წარმომადგენლებსა და სახელმწიფოთა მთავრობებს შორის უპრეცენტო კოლაბორაციამ.[119] 2020 წლის ივნისისთვის კორპორაციების, მთავრობების, საერთაშორისო ჯანდაცვის ორგანიზაციების და უნივერსიტეტების კვლევითი ჯგუფების მხრიდან ათობით მილიარდი დოლარის ინვესტიცია იყო განხორციელებული ათობით კანდიდატის მომზადებაში და გლობალური ვაქცინაციის პროგრამების დაგეგმვაში.[117][120][121][122] ეპიდემიური მზაობის ინოვაციების კოალიციის (CEPI) ინფორმაციით, ვაქცინის შექმნაში აქტივობების 40% ამერიკის კონტინენტზე მოდიოდა, 30% აზიასა და ავსტრალიაზე, 26% ევროპაზე, რამდენიმე პროექტი კი მიმდინარეობდა სამხრეთ ამერიკაში და აფრიკაში.[32][119]
2020 წლის თებერვალში ჯანმომ განაცხადა, რომ SARS‑CoV‑2-ის წინააღმდეგ ვაქცინის ხელმისაწვდომობა მომდევნო 18 თვის განმავლობაში მოსალოდნელი არ იყო.[123] მოგვიანებით, ვირუსოლოგმა პოლ ოფიტმა განაცხადა, რომ ამჟამინდელი გადმოსახედიდან, 11 თვეზე ნაკლებ პერიოდში უსაფრთხო და ეფექტური ვაქცინის შექმნა მართლაც შესანიშნავი შედეგი იყო.[124] საერთაშორისო ალიანსებისა და მთავრობებისთვის დამატებითი სტიმული COVID‑19-ის გავრცელების უსწრაფესი ტემპიც გახდა. შედეგად, მოკლე დროში შეიქმნა ვაქცინის რამდენიმე კანდიდატი,[107] რომელთაგანაც ოთხის გამოცდა ადამიანებზე უკვე მარტში დაიწყო.[32][125]
2020 წლის 24 ივნისს ჩინეთმა გამოსცა ვექტორული CanSino-ს შეზღუდული გამოყენების ნებართვა სამხედრო ძალებში, ასევე, გასცა ორი ინაქტივირებული ვაქცინის გადაუდებელი გამოყენების ავტორიზაცია მაღალი რისკის მქონე პირებისათვის.[63] 2020 წლის 11 აგვისტოს რუსეთმა გასცა ავტორიზაცია Sputnik V-ის გამოყენებაზე გადაუდებელ შემთხვევებში, თუმცა, ერთი თვის შემდეგაც მესამე ფაზის ცდების გარეთ აღნიშნული ვაქცინა შეზღუდულად იყო ხელმისაწვდომი.[54]
2020 წლის 20 ნოემბერს აშშ-ის საკვებისა და წამლის ადმინისტრაციაში (FDA) გადაუდებელი გამოყენების ავტორიზაციის მოთხოვნა შეიტანა Pfizer–BioNTech-ის ალიანსმა; მოთხოვნა ეხებოდა mRNA ტიპის ვაქცინას BNT162b2 (აქტიური ინგრედიენტი ტოზინამერანი).[55][74] 2020 წლის 2 დეკემბერს გაერთიანებული სამეფოს სამედიცინო და ჯანდაცვის პროდუქტების რეგულირების სააგენტომ (MHRA) Pfizer–BioNTech-ის ვაქცინას დროებითი ავტორიზაცია მისცა,[126][76] შედეგად, დიდი ბრიტანეთი გახდა პირველი სახელმწიფო, რომელმაც გასცა ნებართვა ამ ვაქცინაზე და პირბელი დასავლური სახელმწიფო, რომელმაც COVID‑19-ის ვაქცინის ავტორიზაცია გასცა.[127][128][129] 2020 წლის 21 დეკემბრისთვის Pfizer–BioNTech-ის ვაქცინას ევროკავშირის და არაერთი სხვა ქვეყნის ავტორიზაცია ჰქონდა.[130] ბაჰრეინმა და არაბთა გაერთიანებულმა საემიროებმა ავტორიზაცია მისცეს ჩინური Sinopharm-ის წარმოებულ ვაქცინას BBIBP-CorV.[131][132] აშშ-ის საკვებისა და წამლის ადმინისტრაციასმ Pfizer–BioNTech-ის ვაქცინას გადაუდებელი გამოყენების ავტორიზაცია 2020 წლის 11 დეკემბერს მისცა.[133] ერთი კვირის შემდეგ იგივე ტიპის ავტორიზაცია მიიღო Moderna-ს მიერ წარმოებულმა ვაქცინამ mRNA-1273 (აქტიური ინგრედიენტი ელასომერანი.[134][135][136][137]
2021 წლის 31 მარტს რუსეთის მთავრობამ განაცხადა, რომ რეგისტრაციაში გაატარა პირველი COVID‑19-ის ვაქცინა ცხოველებისათვის.[138] ვაქცინა, რომლის სახელწოდებაა Carnivac-Cov, წარმოადგენს ინაქტივირებულ ვაქცინას ხორცისმჭამელი ცხოველებისთვის, შინაური ცხოველების ჩათვლით და მისი მიზანია SARS-CoV-2-ის სახეობათაშორის გადაცემის დროს შესაძლო მუტაციების თავიდან აცილება.[139]
კლინიკური ცდები და ავტორიზაციის სტატუსები[რედაქტირება | წყაროს რედაქტირება]
I ფაზის ცდები, პირველ რიგში, ტარდება უსაფრთხოებისა და წინასწარი დოზირების დასადგენად და მასში რამდენიმე ათეული ჯანმრთელი სუბიექტი მონაწილეობს, ხოლო II ფაზა, წინამორბედი ფაზის წარმატებით დასრულების შემდეგ, აფასებს იმუნოგენურობას, დოზირების დონეებს (ეფექტურობას ბიომარკერების მიხედვით) და ვაქცინის კანდიდატის გვერდით ეფექტებს; მასში, როგორც წესი, რამდენიმე ასეული სუბიექტი მონაწილეობს.[96][97] I–II ფაზის ცდები ახდებს უსაფრთხოების და იმუნოგენურობის შემოწმებას, რენდომიზებულია, კონტროლდება პლაცებოს საშუალებით და მის შედეგად ირკვევა უფრო ზუსტი, ეფექტური დოზირება.[97] III ფაზის ცდებში ბევრად მეტი სუბიექტია ჩართული სხვადასხვა ადგილას, მათ შორის არის საკონტროლო ჯგუფიც. ამ ფაზაში იტესტება ვაქცინის ეფექტურობა კონკრეტული დაავადების პრევენციის კუთხით (ამას „ინტერვენციული“ ცდა ეწოდება). ამავე დროს, გრძელდება ოპტიმალური დოზის გვერდითი ეფექტების.[96][97] სხვადასხვა კომპანიების მიერ ჩატარებულ ცდებში III ფაზის შედეგები განსხვავდება უსაფრთხოების, ეფექტურობის, კლინიკური შედეგების, გვერდითი ეფექტების, ინფიცირების და გადაცემის მხრივ, ასევე, იმის მიხედვით, თუ რამდენად ახდენს ვაქცინა საშუალო ან მწვავე ინფექციის პრევენციას.[98][140][141]
ცდების პროცესში დაგროვებული ინდიკატორების მიხედვით, კლინიკური ცდების მეთოდიკა შეიძლება შეიცვალოს და ადაპტირდეს მკურნალობის ნეგატიური და პოზიტიური შედეგებიდან გამომდინარე.[142][143] ზოგიერთ შემთხვევაში II–III ფაზების ადაპტირება საშუალებას იძლევა, შემცირდეს ცდების ხანგრძლივობა და საჭირო სუბიექტების რაოდენობა, რაც გამორიცხავს დუბლირებულ და არასაჭირო კვლევებს.ამავე დროს, ხდება ცდების დიზაინში და მეთოდებში შეტანილი ცვლილებების გაზიარება საერთაშორისო მასშტაბით, სხვა ადგილებში მიმდინარე ცდების ადაპტირების მიზნით.[142][144]
ამჟამად, ეროვნული რეგულატორების მიერ გადაუდებელი გამოყენებისათვის ავტორიზებულია 15 ვაქცინა. ამათგან 6 ავტორიზებული გადაუდებელი ან სრული გამოყენებისთვის ჯანმოს მიერ აღიარებული სულ მცირე ერთი მკაცრი რეგულატორის მიერ. Pfizer–BioNTech-ს და Moderna-ს აშშ-ის საკვებისა და წამლის ადმინისტრაციაში თავიანთი ვაქცინებისთვის ბიოლოგიური ლიცენზიის აპლიკაციაც აქვთ შეტანილი, რაც ქვეყნის მასშტაბით ახალი ბიოლოგიური პროდუქტით ვაჭრობის ნებართვას ითვალისწინებს.[145][146]
-
mRNA ვაქცინები
-
-
-
საზოგადოება და კულტურა[რედაქტირება | წყაროს რედაქტირება]
განაწილება[რედაქტირება | წყაროს რედაქტირება]



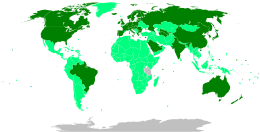
2021 წლის 1 სექტემბრის მონაცემებით, მსოფლიოს მასშტაბით გაკეთებული იყო COVID-19-ის ვაქცინის 5.34 მილირდი დოზა, გლობალური პოპულაციის 39.6 პროცენტს მიღებული ჰქონდა სულ მცირე ერთი დოზა. ამ დროისათვის დღეში 40.5 მილიონი დოზა კეთდებოდა, თუმცა, 2021 წლის სექტემბრისთვის დაბალი შემოსავლის მქონე ქვეყნებში სულ მცირე ერთი დოზა მხოლოდ მოსახლეობის 1.8 პროცენტს ჰქონდა მიღებული. ამის შესახებ ეროვნული ჯანდაცვის ორგანიზაციების მიერ მოწოდებულ მონაცემებს Our World in Data აგროვებს.[147]
სწრაფად გავრცელებადი პანდემიის და 2020 წლის განმავლობაში COVID-19-ის შემთხვევების ზრდის ფონზე საერთაშორისო ორგანიზაციები, როგორიცაა ჯანმო და CEPI, ვაქცინის შექმნაზე მომუშავე ორგანიზაციები, მთავრობები და ფარმაცევტული ინდუსტრიის წარმომადგენლები მუშაობდნენ ვაქცინების განაწილების სქემაზე.[107] ექსპერტები ხაზს უსვამენ, რომ ლიცენზირებული ვაქცინები პირველ რიგში ხელმისაწვდომი უნდა იყოს ჯანდაცვის სფეროში მომუშავე და ყველაზე დიდი საჭიროების მქონე პირებისათვის.[17][117][90]
2020 წლის აპრილში გავრცელდა ინფორმაცია, რომ გაერთიენებული სამეფო დათანხმდა 20 სხვა ქვეყანასთან და საერთაშირისო ორგანიზაციებთან თანამშრომლობას, მათ შორის, საფრანგეთთან, გერმანიასთან და იტალიასთან ვაქცინის შექმნის და კვლევის შედეგების გაზიარების მიზნით, ასევე, დათანხმდა, რომ გერთიანებული სამეფოს მოქალაქეებს არ ექნებოდათ უპირატესობა ბრიტანულ უნივერსიტეტებში შექმნილ ვქცინებზე წვდომაში.[148] რამდენიმე კომპანია გეგმავდა, ეწარმოებინა ვაქცინა ხელოვნურად დაბალი ფასებით, ხოლო გაეზარდა ფასები მომგებიანობის მიზნით მხოლო მას შემდეგ, რაც სახელმწიფოები ვაქცინები საკმარის მარაგებს შექმნიდნენ სამომავლო, ყოველწლიური ვაქცინაციის საჭიროების შემთხვევაში გამოყენების მიზნით.[90]
იმავე თვეში ეპიდემიური მზადყოფნის ინოვაციების კოალიციამ (CEPI) განაცხადა: „აუცილებელია ძლიერი საერთაშორისო კოორდინაცია და თანამშრომლობა ვაქცინების შემქმნელებს, მარეგულირებლებს, პოლიტიკოსებს, სპონსორებს, საზოგადოებრივი ჯანდაცვის ორგანიზაციებს და მთავრობებს შორის, რათა შესაძლებელი გახდეს ვაქცინების სავარაუდო კანდიდატების წარმოება საკმარისი რაოდენობით და მათი თანასწორი განაწილება ყველა, განსაკუთრებით კი, დაბალშემოსავლიან რეგიონებში."[32] CEPI ჯანმოსთან ერთად მუშაობს ფინანსური რესურსების მოზიდვასა და სახელმძღვანელო მითითებების შექმნაზე უსაფრთხო და ეფექტური ვაქცინების გლობალურ განაწილებასთან დაკავშირებით, რაც გამოწვეულია განსხვავებული საჭიროებებით სხვადასხვა ქვეყნებსა და პოპულაციის სხვადასხვა სეგმენტს შორის.[107][119][125][149] მაგალითად, წარმატებული COVID‑19-ის ვაქცინა პირველ რიგში უნდა მიეწოდოს ჰანდაცვის მუშაკებს და ავადმყოფობის მძიმე განვითარების რისკის ქვეშ მყოფ პირებს, როგორიცაა მოხუცები და მჭიდროს დასახლებული ღარიბი მოსახლეობა.[150][151]
ხელმისაწვდომობა[რედაქტირება | წყაროს რედაქტირება]
არაერთმა სახელმწიფომ COVID‑19-ის ვაქცინების შესყიდვის პირობა მათ გამოშვებამდე დადო. მიუხედავად იმისა, რომ მაღალშემოსავლიანი სახელმწიფოები დედამიწის მოსახლეობის მხოლოდ 14%-ს წარმოადგენენ, 2020 წლის 15 ნოემბრისთვის ვაქცინების წინასწარი გაყიდვების 51% სწორედ მათ ჰქონდათ შეკვეთილი. რამდენიმე ასეთმა ქვეყანამ იმაზე მეტი დოზა შეიძინა, ვიდრე მათი მოსახლეობის სრულად ასაცრელად იყო საჭირო.[16]


2021 წლის 18 იანვარს ჯანმოს გენერალურმა დირექტორმა, ტედროს ადანომ გებრეისუსმა ვაქცინების არატნაბარი განაწილების პრობლემასთან დაკავშირებით განაცხადა: „ამჟამად სულ მცირე 49 მაღალშემოსავლიან ქვეყანაში ვაქცინის 39 მილიონზე მეტი დოზაა გაკეთებული. ერთ-ერთ ძალიან დაბალშემოსავლიან ქვეყანაში კი მხოლოდ 25 დოზა გაკეთდა. არა 25 მილიონი, არა 25 ათასი; მხოლოდ 25.“[152]
მარტში ცნობილი გახდა, რომ შეერთებული შტატები ცდილობდა დაერწმუნებინა ბრაზილია, არ შეეძინა რუსული ვაქცინა Sputnik V, შიშობდა რა, რომ ეს ხელს შეუწყობდა „რუსული გავლენის“ ზრდას ლათინურ ამერიკაში.[153] სხვადასხვა ინფორმაციით, ხანგრძლივ ტერიტორიულ კონფლიქტებში ჩართულ ზოგიერთ ქვეყანას ვაქცინებზე წვდომაში ხელი მოწინააღმდეგე ქვეყნებმა შეუშალეს. მაგალითად, პალესტინამ ისრაელი ღაზას სექტორში ვაქცინების შეტანაში ხელის შეშალაში დაადანაშაულა, ხოლო ტაივანმა განაცხადა, რომ მათ მცდელობას, მოეპოვებინათ ვაქცინის დოზები, ხელი ჩინეთმა შეუშალა.[154][155][156]
AstraZeneca-ს ერთი დოზის ღირებულება 47 ეგვიპტურ ფუნტს (EGP) არ აღემატება, თუმცა, სახელისუფლებო სტრუქტურები მას 100-200 ფუნტის ფარგლებში ყიდიან. კარნეგის საერთაშორისო მშვიდობის ფონდის (Carnegie Endowment for International Peace) მტკიცებით, სიღატაკის მაჩვენებელი ეგვიპტეში დაახლოებით 29.7 პროცენტია, რაც, დაახლოებით 30.5 მილიონ ადამიანს წარმოადგენს, რომელთაგანაც დაახლოებით 15 მილიონს ვაქცინაზე წვდომის საშუალება არ ექნებოდა. ადამიანის უფლებადამცველმა აქტივისტმა, ხალედ ალიმ მთავრობის წინაღმდეგ საჩივარი შეიტანა, რითიც აიძულა სახელმწიფო, ვაქცინა უფასოდ მიეწოდებინა საზოგადოების ყველა წევრისთვის.[157]
იმუნოლოგის, დოქტორ ენტონი ფაუჩის მიხედვით, მუტირებული შტამები და ვაქცინების შეზღუდული განაწილება გრძელვადიან რისკებს შეიცავს: „ჩვენ უნდა შევძლოთ მთელი მსოფლიოს ვაქცინირება, არა მხოლოდ საკუთარი ქვეყნის.“[158] ედვარდ ბერგმარკი და არიკ ვიერსონიც ვაქცინაციის გლობალური ძალისხმევის მნიშვნელობას უსვამენ ხაზს და აცხადებენ, რომ მდიდარი ქვეყნების „პირველ რიგში მე“ მენტალობა, საბოლოოდ, საწინააღმდეგო შედეგს გამოიღებს, რამდენადაც ვირუსის გავრცელება ღარიბ ქვეყნებში მეტ ვარიანტებს წარმოშობს, რომელთა წინააღმდეგაც, შესაძლოა, ხელმისაწვდომი ვაქცინები ნაკლებად ეფექტური იყოს.[159]
2021 წლის 10 მარტს შეერთებულმა შტატებმა, ბრიტანეთმა და ევროკავშირის ქვეყნებმა დაბლოკეს 80-ზე მეტი განვითარებადი ქვეყნის მხრიდან COVID‑19-ის საპატენტო უფლებების გაუქმების მცდელობა, რაც ხელს შეუწყობდა ვაქცინების წარმოებას ღარიბი ქვეყნებისთვის.[160] 2021 წლის 5 მაისს ბაიდენის ადმინისტრაციამ განაცხადა, რომ მხარს უჭერს ინტელექტუალური საკუთრების დაცვის გაუქმებას COVID-19-ის ვაქცინებისთვის.[161]
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ Li YD, Chi WY, Su JH, Ferrall L, Hung CF, Wu TC (December 2020). „Coronavirus vaccine development: from SARS and MERS to COVID-19“. Journal of Biomedical Science. 27 (1): 104. doi:10.1186/s12929-020-00695-2. PMC 7749790. PMID 33341119.
- ↑ Subbarao, Kanta (July 2021). „The success of SARS-CoV-2 vaccines and challenges ahead“. Cell Host & Microbe. 29 (7): 1111–1123. doi:10.1016/j.chom.2021.06.016. PMC 8279572. PMID 34265245.
- ↑ Padilla TB (24 February 2021). „No one is safe unless everyone is safe“. BusinessWorld. ციტირების თარიღი: 24 February 2021.
- ↑ Vergano, Dan (5 June 2021). „COVID-19 Vaccines Work Way Better Than We Had Ever Expected. Scientists Are Still Figuring Out Why“. BuzzFeed News. ციტირების თარიღი: 24 June 2021.
- ↑ 5.0 5.1 5.2 5.3 „COVID-19 vaccine tracker (Refresh URL to update)“. vac-lshtm.shinyapps.io. London School of Hygiene & Tropical Medicine. 12 July 2021. ციტირების თარიღი: 10 March 2021.
- ↑ „Approved Vaccines“. COVID 19 Vaccine Tracker, McGill University. 2021-07-12.
- ↑ Beaumont P (18 November 2020). „Covid-19 vaccine: who are countries prioritising for first doses?“. The Guardian. ISSN 0261-3077. ციტირების თარიღი: 26 December 2020.
- ↑ Plotkin SA, Halsey N (January 2021). „Accelerate COVID-19 Vaccine Rollout by Delaying the Second Dose of mRNA Vaccines“. Clinical Infectious Diseases. doi:10.1093/cid/ciab068. PMC 7929065. PMID 33502467.
- ↑ თარგი:Cite ssrn
- ↑ Wang X (February 2021). „Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine“. N Engl J Med (letter). 384 (11): 1576–78. doi:10.1056/NEJMc2036242. PMID 33596350.
- ↑ „More Evidence: Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing“. ReallyCorrect.com. 25 May 2021.
- ↑ „Coronavirus (COVID-19) Vaccinations – Statistics and Research“. Our World in Data. ციტირების თარიღი: 7 February 2021.
- ↑ Buntz B (5 February 2021). „Which companies will likely produce the most COVID-19 vaccine in 2021?“. Pharmaceutical Processing World. ციტირების თარიღი: 1 March 2021.
- ↑ „China can hit 500-mln-dose annual capacity of CanSinoBIO COVID-19 vaccine this year“. Yahoo Sports. Reuters. 27 February 2021. ციტირების თარიღი: 1 March 2021.
- ↑ Mullard A (November 2020). „How COVID vaccines are being divvied up around the world“. Nature. doi:10.1038/d41586-020-03370-6. PMID 33257891. S2CID 227246811.
- ↑ 16.0 16.1 So AD, Woo J (December 2020). „Reserving coronavirus disease 2019 vaccines for global access: cross sectional analysis“. BMJ. 371: m4750. doi:10.1136/bmj.m4750. PMC 7735431. PMID 33323376.
- ↑ 17.0 17.1 17.2 17.3 Gates B (30 April 2020). „The vaccine race explained: What you need to know about the COVID-19 vaccine“. The Gates Notes. დაარქივებულია ორიგინალიდან — 14 May 2020. ციტირების თარიღი: 2 May 2020.
- ↑ Cavanagh D (December 2003). „Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus“. Avian Pathology. 32 (6): 567–82. doi:10.1080/03079450310001621198. PMC 7154303. PMID 14676007.
- ↑ Gao W, Tamin A, Soloff A, D'Aiuto L, Nwanegbo E, Robbins PD, et al. (December 2003). „Effects of a SARS-associated coronavirus vaccine in monkeys“. Lancet. 362 (9399): 1895–96. doi:10.1016/S0140-6736(03)14962-8. PMC 7112457. PMID 14667748.
- ↑ Kim E, Okada K, Kenniston T, Raj VS, AlHajri MM, Farag EA, et al. (October 2014). „Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice“. Vaccine. 32 (45): 5975–82. doi:10.1016/j.vaccine.2014.08.058. PMC 7115510. PMID 25192975.
- ↑ Greenough TC, Babcock GJ, Roberts A, Hernandez HJ, Thomas WD, Coccia JA, et al. (February 2005). „Development and characterization of a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody that provides effective immunoprophylaxis in mice“. The Journal of Infectious Diseases. 191 (4): 507–14. doi:10.1086/427242. PMC 7110081. PMID 15655773.
- ↑ Tripp RA, Haynes LM, Moore D, Anderson B, Tamin A, Harcourt BH, et al. (September 2005). „Monoclonal antibodies to SARS-associated coronavirus (SARS-CoV): identification of neutralizing and antibodies reactive to S, N, M and E viral proteins“. Journal of Virological Methods. 128 (1–2): 21–28. doi:10.1016/j.jviromet.2005.03.021. PMC 7112802. PMID 15885812.
- ↑ Roberts A, Thomas WD, Guarner J, Lamirande EW, Babcock GJ, Greenough TC, et al. (March 2006). „Therapy with a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody reduces disease severity and viral burden in golden Syrian hamsters“. The Journal of Infectious Diseases. 193 (5): 685–92. doi:10.1086/500143. PMC 7109703. PMID 16453264.
- ↑ 24.0 24.1 Jiang S, Lu L, Du L (January 2013). „Development of SARS vaccines and therapeutics is still needed“. Future Virology. 8 (1): 1–2. doi:10.2217/fvl.12.126. PMC 7079997. PMID 32201503.
- ↑ „SARS (severe acute respiratory syndrome)“. National Health Service. 5 March 2020. დაარქივებულია ორიგინალიდან — 9 March 2020. ციტირების თარიღი: 31 January 2020.
- ↑ Shehata MM, Gomaa MR, Ali MA, Kayali G (June 2016). „Middle East respiratory syndrome coronavirus: a comprehensive review“. Frontiers of Medicine. 10 (2): 120–36. doi:10.1007/s11684-016-0430-6. PMC 7089261. PMID 26791756.
- ↑ Butler D (October 2012). „SARS veterans tackle coronavirus“. Nature. 490 (7418): 20. Bibcode:2012Natur.490...20B. doi:10.1038/490020a. PMID 23038444.
- ↑ Modjarrad K, Roberts CC, Mills KT, Castellano AR, Paolino K, Muthumani K, et al. (September 2019). „Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial“. The Lancet. Infectious Diseases. 19 (9): 1013–22. doi:10.1016/S1473-3099(19)30266-X. PMC 7185789. PMID 31351922.
- ↑ Yong CY, Ong HK, Yeap SK, Ho KL, Tan WS (2019). „Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus“. Frontiers in Microbiology. 10: 1781. doi:10.3389/fmicb.2019.01781. PMC 6688523. PMID 31428074.
- ↑ Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, et al. (2020). „Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines“. Frontiers in Immunology. 11: 579250. doi:10.3389/fimmu.2020.579250. PMC 7566192. PMID 33123165.
- ↑ 31.0 31.1 31.2 31.3 31.4 31.5 31.6 Le TT, Cramer JP, Chen R, Mayhew S (October 2020). „Evolution of the COVID-19 vaccine development landscape“. Nature Reviews. Drug Discovery. 19 (10): 667–68. doi:10.1038/d41573-020-00151-8. PMID 32887942. S2CID 221503034.
- ↑ 32.0 32.1 32.2 32.3 32.4 32.5 32.6 32.7 Thanh Le T, Andreadakis Z, Kumar A, Gómez Román R, Tollefsen S, Saville M, Mayhew S (May 2020). „The COVID-19 vaccine development landscape“. Nature Reviews. Drug Discovery. 19 (5): 305–06. doi:10.1038/d41573-020-00073-5. PMID 32273591. შეცდომა ციტირებაში Invalid
<ref>tag; name "thanh" defined multiple times with different content; $2 - ↑ 33.0 33.1 33.2 Diamond MS, Pierson TC (May 2020). „The Challenges of Vaccine Development against a New Virus during a Pandemic“. Cell Host & Microbe. 27 (5): 699–703. doi:10.1016/j.chom.2020.04.021. PMC 7219397. PMID 32407708.
- ↑ Cross R (29 September 2020). „The tiny tweak behind COVID-19 vaccines“. Chemical & Engineering News. 98 (38).
- ↑ Krammer F (October 2020). „SARS-CoV-2 vaccines in development“. Nature. 586 (7830): 516–27. Bibcode:2020Natur.586..516K. doi:10.1038/s41586-020-2798-3. PMID 32967006. S2CID 221887746.
- ↑ Park KS, Sun X, Aikins ME, Moon JJ (February 2021). „Non-viral COVID-19 vaccine delivery systems“. Advanced Drug Delivery Reviews. 169: 137–51. doi:10.1016/j.addr.2020.12.008. PMC 7744276. PMID 33340620.
- ↑ Kowalski PS, Rudra A, Miao L, Anderson DG (April 2019). „Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery“. Molecular Therapy. 27 (4): 710–28. doi:10.1016/j.ymthe.2019.02.012. PMC 6453548. PMID 30846391.
- ↑ Verbeke R, Lentacker I, De Smedt SC, Dewitte H (October 2019). „Three decades of messenger RNA vaccine development“. Nano Today. 28: 100766. doi:10.1016/j.nantod.2019.100766.
- ↑ „COVID-19 ACIP Vaccine Recommendations“. U.S. Centers for Disease Control and Prevention (CDC). ციტირების თარიღი: 18 February 2021.
- ↑ „Safe COVID-19 vaccines for Europeans“. European Commission – European Commission. ციტირების თარიღი: 19 February 2021.
- ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისhcregარ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04368728არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისEudraCT-2020-001038-36არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04470427არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისpalcaარ არის მითითებული ტექსტი; $2 - ↑ „CureVac Final Data from Phase 2b/3 Trial of First-Generation COVID-19 Vaccine Candidate, CVnCoV, Demonstrates Protection in Age Group of 18 to 60“. CureVac (პრეს-რელიზი). 30 June 2021. ციტირების თარიღი: 2 July 2021.
- ↑ 47.0 47.1 47.2 Moghimi SM (2021). „Allergic Reactions and Anaphylaxis to LNP-Based COVID-19 Vaccines“. Molecular Therapy. 29 (3): 898–900. doi:10.1016/j.ymthe.2021.01.030. PMC 7862013. PMID 33571463.
- ↑ 48.0 48.1 „What are viral vector-based vaccines and how could they be used against COVID-19?“. Gavi, the Vaccine Alliance (GAVI). 2020. ციტირების თარიღი: 26 January 2021.
- ↑ „Understanding Viral Vector COVID-19 Vaccines“. U.S. Centers for Disease Control and Prevention (CDC). 13 April 2021. ციტირების თარიღი: 19 April 2021.
- ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04400838არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისEudraCT-2020-001228-32არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისISRCTN89951424არ არის მითითებული ტექსტი; $2 - ↑ Corum J, Carl Z (8 January 2021). „How Gamaleya's Vaccine Works“. The New York Times. ციტირების თარიღი: 27 January 2021.
- ↑ 54.0 54.1 შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვის:2არ არის მითითებული ტექსტი; $2 - ↑ 55.0 55.1 შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვის:3არ არის მითითებული ტექსტი; $2 - ↑ Johnson C, McGinley L. „Johnson & Johnson seeks emergency FDA authorization for single-shot coronavirus vaccine“. The Washington Post.
- ↑ „It's not just Johnson & Johnson: China has a single-dose COVID-19 vaccine that's 65% effective“. Fortune. ციტირების თარიღი: 28 February 2021.
- ↑ Wu S, Zhong G, Zhang J, Shuai L, Zhang Z, Wen Z, et al. (August 2020). „A single dose of an adenovirus-vectored vaccine provides protection against SARS-CoV-2 challenge“. Nat Commun. 11 (1): 4081. Bibcode:2020NatCo..11.4081W. doi:10.1038/s41467-020-17972-1. PMC 7427994. PMID 32796842.
- ↑ Single dose vaccine, Sputnik Light, authorized for use in Russia en. ციტირების თარიღი: 2021-08-12
- ↑ Petrovsky N, Aguilar JC (October 2004). „Vaccine adjuvants: current state and future trends“. Immunology and Cell Biology. 82 (5): 488–96. doi:10.1111/j.0818-9641.2004.01272.x. PMID 15479434. S2CID 154670.
- ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04383574არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCname= nct04456595=არ არის მითითებული ტექსტი; $2 - ↑ 63.0 63.1 შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვის:1არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისChiCTR2000034780არ არის მითითებული ტექსტი; $2 - ↑ Ivanova P (20 February 2021). „Russia approves its third COVID-19 vaccine, CoviVac“. Reuters. ციტირების თარიღი: 11 April 2021.
- ↑ „Kazakhstan rolls out its own COVID-19 vaccine“. Reuters. 27 April 2021. ციტირების თარიღი: 2 July 2021.
- ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისprecisionvaccinations-20201231არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისclinicaltrials-20201230არ არის მითითებული ტექსტი; $2 - ↑ „Module 2 – Subunit vaccines“. WHO Vaccine Safety Basics.
- ↑ „Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona)“. ClinicalTrials.gov. 22 September 2020. NCT04368988. ციტირების თარიღი: 16 November 2020.
- ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04368988არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04495933არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვის:7არ არის მითითებული ტექსტი; $2 - ↑ 74.0 74.1 შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვის:4არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04336410არ არის მითითებული ტექსტი; $2 - ↑ 76.0 76.1 შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვის:5არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04463472არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04445389არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისgen-reutარ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04299724არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04276896არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისNCT04608305არ არის მითითებული ტექსტი; $2 - ↑ Palca J (6 April 2021). „Scientists Race to Develop Next Generation of COVID Vaccines“. NPR.
- ↑ Johnson CY, Mufson S (11 June 2020). „Can old vaccines from science's medicine cabinet ward off coronavirus?“. The Washington Post. ISSN 0190-8286. ციტირების თარიღი: 31 December 2020.
- ↑ „Bacille Calmette-Guérin (BCG) vaccination and COVID-19“. World Health Organization (WHO). 12 April 2020. დაარქივებულია ორიგინალიდან — 30 April 2020. ციტირების თარიღი: 1 May 2020.
- ↑ 86.0 86.1 86.2 Tregoning JS, Russell RF, Kinnear E (March 2018). „Adjuvanted influenza vaccines“. Human Vaccines & Immunotherapeutics. 14 (3): 550–64. doi:10.1080/21645515.2017.1415684. PMC 5861793. PMID 29232151.
- ↑ 87.0 87.1 87.2 87.3 Wang J, Peng Y, Xu H, Cui Z, Williams RO (August 2020). „The COVID-19 Vaccine Race: Challenges and Opportunities in Vaccine Formulation“. AAPS PharmSciTech. 21 (6): 225. doi:10.1208/s12249-020-01744-7. PMC 7405756. PMID 32761294.
- ↑ Simpson S, Kaufmann MC, Glozman V, Chakrabarti A (May 2020). „Disease X: accelerating the development of medical countermeasures for the next pandemic“. The Lancet. Infectious Diseases. 20 (5): e108–15. doi:10.1016/S1473-3099(20)30123-7. PMC 7158580. PMID 32197097.
- ↑ 89.0 89.1 89.2 89.3 Sanger DE, Kirkpatrick DD, Zimmer C, Thomas K, Wee SL (2 May 2020). „With Pressure Growing, Global Race for a Vaccine Intensifies“. The New York Times. ISSN 0362-4331. დაარქივებულია ორიგინალიდან — 11 May 2020. ციტირების თარიღი: 2 May 2020.
- ↑ 90.0 90.1 90.2 90.3 90.4 90.5 Steenhuysen J, Eisler P, Martell A, Nebehay S (27 April 2020). „Special Report: Countries, companies risk billions in race for coronavirus vaccine“. Reuters. დაარქივებულია ორიგინალიდან — 15 May 2020. ციტირების თარიღი: 2 May 2020.
- ↑ Jeong-ho L, Zheng W, Zhou L (26 January 2020). „Chinese scientists race to develop vaccine as coronavirus death toll jumps“. South China Morning Post. დაარქივებულია ორიგინალიდან — 26 January 2020. ციტირების თარიღი: 28 January 2020.
- ↑ Wee SL (4 May 2020). „China's coronavirus vaccine drive empowers a troubled industry“. The New York Times. ISSN 0362-4331. დაარქივებულია ორიგინალიდან — 4 May 2020. ციტირების თარიღი: 4 May 2020.
- ↑ Thorp HH (March 2020). „Underpromise, overdeliver“. Science. 367 (6485): 1405. Bibcode:2020Sci...367.1405T. doi:10.1126/science.abb8492. PMID 32205459.
- ↑ Blackwell T (20 April 2020). „COVID-19 vaccine researchers say pandemic lockdown placing many serious obstacles to their work“. National Post. დაარქივებულია ორიგინალიდან — 23 April 2020. ციტირების თარიღი: 3 May 2020.
- ↑ Chen J (4 May 2020). „Covid-19 has shuttered labs. It could put a generation of researchers at risk“. Stat. დაარქივებულია ორიგინალიდან — 6 May 2020. ციტირების თარიღი: 4 May 2020.
- ↑ 96.0 96.1 96.2 „Vaccine Safety – Vaccines“. US Department of Health and Human Services. დაარქივებულია ორიგინალიდან — 22 April 2020. ციტირების თარიღი: 13 April 2020.
- ↑ 97.0 97.1 97.2 97.3 „The drug development process“. U.S. Food and Drug Administration (FDA). 4 January 2018. დაარქივებულია ორიგინალიდან — 22 February 2020. ციტირების თარიღი: 12 April 2020.
- ↑ 98.0 98.1 Cohen J (June 2020). „Pandemic vaccines are about to face the real test“. Science. 368 (6497): 1295–96. Bibcode:2020Sci...368.1295C. doi:10.1126/science.368.6497.1295. PMID 32554572.
- ↑ Dubé E, Laberge C, Guay M, Bramadat P, Roy R, Bettinger J (August 2013). „Vaccine hesitancy: an overview“. Human Vaccines & Immunotherapeutics. 9 (8): 1763–73. doi:10.4161/hv.24657. PMC 3906279. PMID 23584253.
- ↑ Howard J, Stracqualursi V (18 June 2020). „Fauci warns of 'anti-science bias' being a problem in US“. CNN. დაარქივებულია ორიგინალიდან — 21 June 2020. ციტირების თარიღი: 21 June 2020.
- ↑ „Vaccines: The Emergency Authorisation Procedure“. European Medicines Agency (EMA). 2020. დაარქივებულია ორიგინალიდან — 24 September 2020. ციტირების თარიღი: 21 August 2020.
- ↑ Byrne J (19 October 2020). „Moderna COVID-19 vaccine under rolling review process in Canada, EU“. BioPharma-Reporter.com, William Reed Business Media Ltd. ციტირების თარიღი: 25 November 2020.
- ↑ Dangerfield K (20 November 2020). „Pfizer files for emergency use of coronavirus vaccine in U.S. – what about in Canada?“. Global News. ციტირების თარიღი: 25 November 2020.
- ↑ „G20 launches initiative for health tools needed to combat the coronavirus“. The Globe and Mail. 25 April 2020.
- ↑ „Access to COVID-19 Tools (ACT) Accelerator“ (PDF). World Health Organization (WHO). 24 April 2020.
- ↑ „The ACT-Accelerator: frequently asked questions (FAQ)“. World Health Organization (WHO). 2020. ციტირების თარიღი: 16 December 2020.
- ↑ 107.0 107.1 107.2 107.3 „Update on WHO Solidarity Trial – Accelerating a safe and effective COVID-19 vaccine“. World Health Organization (WHO). 27 April 2020. დაარქივებულია ორიგინალიდან — 30 April 2020. ციტირების თარიღი: 2 May 2020. ციტატა: „It is vital that we evaluate as many vaccines as possible as we cannot predict how many will turn out to be viable. To increase the chances of success (given the high level of attrition during vaccine development), we must test all candidate vaccines until they fail. [The] WHO is working to ensure that all of them have the chance of being tested at the initial stage of development. The results for the efficacy of each vaccine are expected within three to six months and this evidence, combined with data on safety, will inform decisions about whether it can be used on a wider scale.“ შეცდომა ციტირებაში Invalid
<ref>tag; name "who-accel" defined multiple times with different content; $2 - ↑ Abedi M (23 March 2020). „Canada to spend $192M on developing COVID-19 vaccine“. Global News. დაარქივებულია ორიგინალიდან — 9 April 2020. ციტირების თარიღი: 24 March 2020.
- ↑ „Government of Canada's research response to COVID-19“. Government of Canada. 23 April 2020. დაარქივებულია ორიგინალიდან — 13 May 2020. ციტირების თარიღი: 4 May 2020.
- ↑ Takada N, Satake M (2 May 2020). „US and China unleash wallets in race for coronavirus vaccine“. Nikkei Asian Review. დაარქივებულია ორიგინალიდან — 10 May 2020. ციტირების თარიღი: 3 May 2020.
- ↑ Morriss E (22 April 2020). „Government launches coronavirus vaccine taskforce as human clinical trials start“. Pharmafield. დაარქივებულია ორიგინალიდან — 17 June 2020. ციტირების თარიღი: 3 May 2020.
- ↑ Kuznia R, Polglase K, Mezzofiore G (1 May 2020). „In quest for vaccine, US makes 'big bet' on company with unproven technology“. CNN. დაარქივებულია ორიგინალიდან — 13 May 2020. ციტირების თარიღი: 2 May 2020.
- ↑ Cohen J (May 2020). „U.S. 'Warp Speed' vaccine effort comes out of the shadows“. Science. 368 (6492): 692–93. Bibcode:2020Sci...368..692C. doi:10.1126/science.368.6492.692. PMID 32409451.
- ↑ Sink J, Fabian J, Griffin R (15 May 2020). „Trump introduces 'Warp Speed' leaders to hasten COVID-19 vaccine“. Bloomberg. დაარქივებულია ორიგინალიდან — 21 May 2020. ციტირების თარიღი: 15 May 2020.
- ↑ LaHucik, Kyle (17 June 2021). „U.S. injects $3B-plus into COVID-19 research to develop antiviral pill within a year“. Fierce Biotech. ციტირების თარიღი: 11 July 2021.
- ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისwho-timeარ არის მითითებული ტექსტი; $2 - ↑ 117.0 117.1 117.2 შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისgates1არ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისFauciარ არის მითითებული ტექსტი; $2 - ↑ 119.0 119.1 119.2 Le TT, Cramer JP, Chen R, Mayhew S (October 2020). „Evolution of the COVID-19 vaccine development landscape“. Nature Reviews. Drug Discovery. 19 (10): 667–668. doi:10.1038/d41573-020-00151-8. PMID 32887942. S2CID 221503034.
- ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისhbrარ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისcbcrარ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვისahmedარ არის მითითებული ტექსტი; $2 - ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვის:0არ არის მითითებული ტექსტი; $2 - ↑ Offit, Paul. TWiV 720: With vaccines, Offit is on it en. Vincent Racaniello Youtube Channel. ციტირების თარიღი: 14 July 2021
- ↑ 125.0 125.1 Yamey G, Schäferhoff M, Hatchett R, Pate M, Zhao F, McDade KK (May 2020). „Ensuring global access to COVID-19 vaccines“. Lancet. 395 (10234): 1405–1406. doi:10.1016/S0140-6736(20)30763-7. PMC 7271264. PMID 32243778. ციტატა: „CEPI estimates that developing up to three vaccines in the next 12–18 months will require an investment of at least აშშ $2
billion. This estimate includes Phase
1 clinical trials of eight vaccine candidates, progression of up to six candidates through Phase
2 and
3 trials, completion of regulatory and quality requirements for at least three vaccines, and enhancing global manufacturing capacity for three vaccines.“ line feed character არის
|quote=-ში №204 პოზიციაზე (დახმარება) - ↑ Information for Healthcare Professionals on Pfizer/BioNTech COVID-19 vaccine (8 December 2020). ციტირების თარიღი: 13 December 2020
- ↑ UK medicines regulator gives approval for first UK COVID-19 vaccine. Medicines and Healthcare Products Regulatory Agency, Government of the UK (2 December 2020). ციტირების თარიღი: 2 December 2020
- ↑ Mueller, Benjamin (2 December 2020). „U.K. Approves Pfizer Coronavirus Vaccine, a First in the West“. The New York Times. ციტირების თარიღი: 2 December 2020.
- ↑ შეცდომა ციტირებაში არასწორი ტეგი
<ref>; სქოლიოსათვის:6არ არის მითითებული ტექსტი; $2 - ↑ Questions and Answers: COVID-19 vaccination in the EU (21 December 2020). ციტირების თარიღი: 21 December 2020
- ↑ „Bahrain second in the world to approve the Pfizer/BioNTech Covid-19 vaccine“. Bahrain News Agency. 4 December 2020. ციტირების თარიღი: 9 December 2020.
- ↑ „UAE: Ministry of Health announces 86 per cent vaccine efficacy“. Gulf News. ციტირების თარიღი: 9 December 2020.
- ↑ Thomas K, LaFraniere S, Weiland N, Goodnough A, Haberman M (12 December 2020). „F.D.A. Clears Pfizer Vaccine, and Millions of Doses Will Be Shipped Right Away“. The New York Times. ციტირების თარიღი: 12 December 2020.
- ↑ „FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine“. U.S. Food and Drug Administration (FDA) (პრეს-რელიზი). ციტირების თარიღი: 18 December 2020.
- ↑ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (January 2021). „The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine - United States, December 2020“ (PDF). MMWR Morbidity and Mortality Weekly Report. 69 (5152): 1653–56. doi:10.15585/mmwr.mm695152e1. PMID 33382675. S2CID 229945697.
- ↑ Lovelace Jr B (19 December 2020). „FDA approves second Covid vaccine for emergency use as it clears Moderna's for U.S. distribution“. CNBC. ციტირების თარიღი: 19 December 2020.
- ↑ Corum J, Zimmer C. „How the Oxford-AstraZeneca Vaccine Works“. The New York Times.
- ↑ Tétrault-Farber M, Vasilyeva G (31 March 2021). „Russia registers world's first COVID-19 vaccine for animals“. Reuters (ინგლისური).
- ↑ „В России зарегистрировали первую в мире вакцину против COVID-19 для животных“ [The world's first COVID-19 vaccine for animals was registered in Russia]. TASS (Russian). Moscow. 31 March 2021. ციტირების თარიღი: 19 May 2021.
- ↑ „How flu vaccine effectiveness and efficacy are measured“. U.S. Centers for Disease Control and Prevention (CDC). 29 January 2016. დაარქივებულია ორიგინალიდან — 7 May 2020. ციტირების თარიღი: 6 May 2020.
- ↑ „Principles of epidemiology, Section 8: Concepts of disease occurrence“. U.S. Centers for Disease Control and Prevention (CDC). 18 May 2012. დაარქივებულია ორიგინალიდან — 6 April 2020. ციტირების თარიღი: 6 May 2020.
- ↑ 142.0 142.1 Pallmann P, Bedding AW, Choodari-Oskooei B, Dimairo M, Flight L, Hampson LV, et al. (February 2018). „Adaptive designs in clinical trials: why use them, and how to run and report them“. BMC Medicine. 16 (1): 29. doi:10.1186/s12916-018-1017-7. PMC 5830330. PMID 29490655.
- ↑ „Adaptive designs for clinical trials of drugs and biologics: Guidance for industry“ (PDF). U.S. Food and Drug Administration (FDA). 1 November 2019. დაარქივებულია ორიგინალიდან — 13 December 2019. ციტირების თარიღი: 3 April 2020.
- ↑ „An international randomised trial of candidate vaccines against COVID-19: Outline of Solidarity vaccine trial“ (PDF). World Health Organization (WHO). 9 April 2020. დაარქივებულია (PDF) ორიგინალიდან — 12 May 2020. ციტირების თარიღი: 9 May 2020.
- ↑ „Pfizer and BioNTech Initiate Rolling Submission of Biologics License Application for U.S. FDA Approval of Their COVID 19 Vaccine“. Pfizer (პრეს-რელიზი). 7 May 2021. ციტირების თარიღი: 9 June 2021.
- ↑ „Moderna Announces Initiation of Rolling Submission of Biologics License Application (BLA) with U.S. FDA for the Moderna COVID-19 Vaccine“ (პრეს-რელიზი). Moderna. 1 June 2021. ციტირების თარიღი: 9 June 2021 – წარმოდგენილია Business Wire-ის მიერ.
- ↑ Richie H., Ortiz-Ospina E, Beltekian D, Methieu E, Hasell J., Macdonald B., Giattino C., Appel C., Rodes-Guirao L., Roser M. (1 September 2021). „Coronavirus (COVID-19) Vaccinations - Statistics and Research“. Our World in Data.CS1-ის მხარდაჭერა: იყენებს ავტორის პარამეტრს (link)
- ↑ Gartner A, Roberts L (3 May 2020). „How close are we to a coronavirus vaccine? Latest news on UK trials“. The Telegraph. ISSN 0307-1235. დაარქივებულია ორიგინალიდან — 4 May 2020. ციტირების თარიღი: 3 May 2020.
- ↑ An international randomised trial of candidate vaccines against COVID-19: Outline of Solidarity vaccine trial. World Health Organization (9 April 2020). ციტირების თარიღი: 9 May 2020
- ↑ COVAX: Ensuring global equitable access to COVID-19 vaccines. GAVI (2020). ციტირების თარიღი: 28 August 2020
- ↑ R&D Blueprint: A coordinated global research roadmap – 2019 novel coronavirus. World Health Organization (1 March 2020). ციტირების თარიღი: 10 May 2020
- ↑ WHO Director-General's opening remarks at 148th session of the Executive Board. World Health Organization (WHO) (18 January 2021). ციტირების თარიღი: 25 January 2021
- ↑ U.S. pressured Brazil to ditch Russia's Sputnik V vaccine (15 March 2021). ციტირების თარიღი: 21 March 2021
- ↑ Holmes O (16 February 2021). „Israel blocked Covid vaccines from entering Gaza, say Palestinians“. The Guardian. ციტირების თარიღი: 17 February 2021.
- ↑ Rasgon A (4 February 2021). „Israel's Vaccine Success Unleashes a Debate on Palestinian Inequities“. The New York Times. ციტირების თარიღი: 17 February 2021.
- ↑ Horton C (17 February 2021). „Taiwan Concerned China May Have Blocked Vaccine Purchase“. Bloomberg. ციტირების თარიღი: 17 February 2021.
- ↑ Playing Politics with Poverty: Sisi's COVID-19 Vaccine Strategy. ციტირების თარიღი: 25 February 2021
- ↑ Dr. Fauci: Variants reveal COVID-19 vaccination as global job (9 February 2021). ციტირების თარიღი: 4 March 2021
- ↑ Opinion: Without a global vaccine plan, coronavirus variants could lead to untold number of deaths (26 February 2021). ციტირების თარიღი: 4 March 2021
- ↑ Rich, developing nations wrangle over COVID vaccine patents (10 March 2021). ციტირების თარიღი: 19 June 2021
- ↑ U.S. backs waiving patent protections for Covid vaccines, citing global health crisis (5 May 2021). ციტირების თარიღი: 5 May 2021




