დიაზოტის ტეტრაოქსიდი
| დიაზოტის ტეტრაოქსიდი | |
 | |
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | აზოტის ტეტრაოქსიდი |
| ქიმიური ფორმულა | N2O4 |
| მოლური მასა | 92.011 გ/მოლი |
| ფიზიკური თვისებები | |
| მდგომარეობა (სტ. პირ.) | უფერო სითხე/ფორთხოხლისფერი აირი |
| სიმკვრივე | 1.44246 გ/სმ3 (სითხე, 21 °C) გ/სმ³ |
| თერმული თვისებები | |
| დნობის ტემპერატურა | −11.2 °C |
| დუღილის ტემპერატურა | 21.69 °C |
| აფეთქების ტემპერატურა | არააალებადი °C |
| ორთქლის წნევა | 96 კპა (20 °C)[1] |
| ქიმიური თვისებები | |
| ხსნადობა წყალში | მოქმედებს გ/100 მლ |
| ოპტიკური თვისებები | |
| გარდატეხის მაჩვენებელი | 1.00112 |
| სტრუქტურა | |
| კრისტალური სტრუქტურა | ბრტყელი, D2h |
| დიპოლური მომენტი | ნული დ |
| კლასიფიკაცია | |
| CAS | 10544-72-6 |
| PubChem | 25352 |
| EINECS | 234-126-4 |
| SMILES |
|
| RTECS | QW9800000 |
დიაზოტის ტეტრაოქსიდი, რომელიც ძირითადად მოიხსენიება როგორც აზოტის ტეტრაოქსიდი, წარმოადგენს ქიმიურ ნივთიერებას ფორმულით N2O4. ის ქიმიური სინთეზის ერთ-ერთი ყველაზე საჭირო საჭირო რეაქტივია. ის თანაბარ წონასწორობაში იმყოფება აზოტის დიოქსიდთან.
დიაზოტის ტეტრაოქსიდი ძლიერ მჟანგავს წარმოადგენს, რომელიც ჰიპერგოლურია (თვითაალებადია) ჰიდრაზინის სხვადასხვა ფორმებთან, რაც ამ წყვილს უმნიშნველოვანეს სარაკეტო საწვავად აქცევს.
სტრუქტურა და თვისებები[რედაქტირება | წყაროს რედაქტირება]
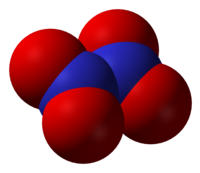
დიაზოტის ტეტორქსიდი შეიძლება განვიხილოთ, როგორც ორი ნიტროგჯუფის (-NO2) ნაერთი ერთმანეთთან. ის წარმოქმნის ქიმიურ წონაწორობას აზოტის დიოქსიდთან .[2] მოლეკულა ბრტყელი ტიპისაა N-N ბმის სიგრძით 1.78 Å და N-O ბმის დაშორებით 1.19 Å. N-N ბმა შეესაბამება უფრო სუსტ ბმას, რადგან ის გაცილებით დიდია, ვიდრე ჩვეულებრივი N-N ერთმაგი ბმა, რომელიც 1.45 Å სიგრძისაა.[3]
NO2-ისაგან განსხვავებით N2O4-ის მოლეკულა დიამაგნიტურიამ რადგან ის გაუწყვილებელ ელექტრონებს შეიცავს.[4] სითხე უფეროა, მაგრამ შეიძლება მოყავისფრო-მოყვითალო ფერი ჰქონდეს მასში NO2ის არსებობის გამო, რომელიც შემდეგ რეაქციას შეესაბამება:
- N2O4 ⇌ 2 NO2
ტემპერატურის აწევა წონასწორობას მარჯვენა მხარეს წევს. შესაბამისად გარდაუვალია დიაზოტის ტეტრაოქსიდის შემცველობა სმოგში, რომელიც ძირითადად აზოტის დიოქსიდისაგან შედგება.
წარმოება[რედაქტირება | წყაროს რედაქტირება]
დიაზოტის ტეტორქსიდის წარმოება მიმდინარეობს ამიაკის კატალიზური დაჟანგვით: ორთქლში, რომელიც ჟანგვის ტემპერატურის დასაწევად გამოიყენება გამხსნელის სახით. პირველ საფეხურში ამიაკი იჟანგება აზოტოვან ოქსიდამდე:
- 4NH3 + 5O2 → 4NO + 6H2O
წყლის უმეტესი ნაწილი კონდენსირდება. აირების დარჩენილი ნაწილი ცივდება. წარმოქმნილი აზოტოვანი ოქსიდი იჟანგება აზოტის დიოქსიდამდე, რომელიც შემდეგ დიმერიზირდება დიაზოტის ტეტრაოქსიდში:
- 2NO + O2 → 2NO2
- 2NO2 ⇌ N2O4
დარჩენილი წყალი რეაქციის არედან აზოტმჟავის სახით შორდება. აირი ძირითადად სუფთა აზოტის დიოქსიდისაგან შედგება, რომელიც დიაზოტის ტეტრაოქსიდში კონდენსირდება ცივ გამათხევადებელ ჭურჭელში.
დიაზოტის ტეტრაოქსიდის წარმოება ასევე შესაძლებელია კონცენტრირებული აზოტმჟავისა და მეტალური სპილენძის ურთიერთქმედებით. სინთეზის ეს გზა უფრო ლაბორატორიებში გამოიყენება და ჩვეულებრივ სადემონსტრაციო რეაქციას წარმოადგენს საწყებით სკოლებში. აზოტმჟავის მიერ სპილენძის ჟანგვის პროცესი კომპლექსური პროცესია და მის შედეგად აზოტმჟავის კონცენტრაციაზე, ჟანგბადის თანაარსებობაზე და სხვა ფაქტორებზე დამოკიდებულებვით აზოტის ოქსიდების მთელი რიგი წარმოიქმნება. მიუხედავად ამისა, რეაქციის არასტაბილური პროდუქტების ჟანგვის საბოლოო შედეგს მაინც აზოტის დიოქსიდი წარმოადგენს, რომლის გაშრობის, გასუფთავებისა და გაციების შემდეგ მაინც თხევად დიაზოტის ტეტრაოქსიდს მივიღებთ.
სარაკეტო საწვავად გამოყენება[რედაქტირება | წყაროს რედაქტირება]
დიაზოტის ტეტრაოქსიდი გამოყენება სარაკეტო საწვავებში მჟანგავად მის ერთ-ერთ უმნიშვნელოვანეს გამოყენების სფეროს წარმოადგენს იმიტომ, რომ მისი შენახვა თხევად მდგომარეობაში შესაძლებელია ოთახის ტემპერატურაზეც. პირველად დიაზოტის ტეტრაოქსიდის სარაკეტო მჟანგავად გამოიყენეს გერმანელებმა 1944 წელს, თუმცა მაშინ ის მხოლოდ უმნიშვნელო ნაწილს წარმოადგენდა ე.წ. S-Stoffისა, რომელიც სინამდვილეში [[წითლად მბოლავი აზოტმჟავა|წითლად მბოლავ აზოტმჟავას წარმოადგენდა. 1950-იან წლებში ის აირჩიეს როგორც შენახვადი მჟანგავი საკმაოდ დიდი რაოდენობის რაკეტებში გამოსაყენებლად როგორც საბჭოთა კავშირში, ისე აშშ-ში. ის ჰიპერგოლურია ჰიდრაზინთან შეხებისას. ამ წყვილის ერთ-ერთი პირველი გამოყენება მოხდა ტიტანის სარაკეტო ოჯახში, რომლებიც ერთ-ერთ პირველ ინტერკონტინენტალურ ბალისტიკურ რაკეტას წარმოადგენდა და შემდგომში გამოიყენებოდა როგორც გამშვები ხომალდი ბევრი კოსმოსური ხომალდისათვის. ის გამოიყენებოდა როგორც აშშ-ს Gemini-სა და Apollo კოსმოსურ ხომალდებზე, ასევე Space Shuttle-ზე. ის დღემდე გამოიყენება როგორც გეოსტაციონარული თანამგზავრების ორბიტაზე შესანარჩუნებელი ძრავებისათვისა და ღრმა კოსმოსის შემსწავლელ ცდებზე. როგორც ჩანს, NASA აპირებს გააგრძელოს ამ მჟანგავის გამოყენება იმ ხომალდებზე, რომლებიც Space Shuttle-ს შეცვლიან. ის ასევე წამყვანი მჟანგავია რუსულ რაკეტა "პროტონ"-ზე.
საწვავად გამოყენებისას დიაზოტის ტეტროქსიდი ჩვეულებრივ მოიხსენიება როგორც 'აზოტის ტეტროქსიდი' და აბრევიატურა 'ნტო'. დამატებით, მცირე პროცენტულობით ნტო ასევე გამოიყენება აზოტოვანი ოქსიდის მცირე დანამატებით, რომელიც ხელს უშლის ტიტანის შენადნობებში სტრესულ-კოროზიული ბზარების გაჩენას. ამის გამო საწვავად მზა ნტო ხშირად მოიხსენიება როგორც "აზოტის ოქსიდების ნარევი" ან "აონ". თანამედროვე სარაკეტო სისტემებში უფრო და უფრო ხშირად გამოიყენება აონ ნტო-ს ნაცვლად; მაგალითად, Space Shuttle რეაქციის კონტროლის სისტემა იყენებდა აონ3-ს(ნტო 3% NO-ს შემცველობით.[5]
აპოლონ-სოიუზის შემთხვევა[რედაქტირება | წყაროს რედაქტირება]
1975 წლის 24 ივლისს ნტო-თი მოიწამლა სამი აშშ-ს წარმომადგენელი ასტრონავტი, რომლებიც იმყოფებოდნენ აპოლო-სიუზის სატესტო პროექზე დაშვებისას. შემთხვევა მოხდა გადამრთველის არასწორი პოზიციაში დატოვების გამო, რამაც გამოიწვია ნტო-ს ორთქლის აპოლონის კოსმოსური ხომალდის შიდა სავენტილაციო სისტემაში მოხვედრა. დაშვებისას ერთმა ასტრონავტმა გონებაც კი დაკარგა. დაშვების შემდეგ ეკიპაჟი საავადმყოფოში იწვა 14 წლის განმავლობაში ქიმიურად გამოწვეული პნევმონიისა და ედემის გამო.[6]
ელექტროგენერატორები N2O4-ის ბაზაზე[რედაქტირება | წყაროს რედაქტირება]
ტენდენცია. რომ N2O4 შეიძლება შექცევადად დაიშალოს NO2-ად, მიგვიყვანა კვლევებამდე, რომლებიც მიმართული იყო ე.წ. დისოციაციური გაზის გამოყენებით მაღალტექნოლოგიურ ელ-გენერატორების შემუშავებაზე[7] "ცივი" დიაზოტის ტეტორქსიდი იკუმშება და თბება, რაც მის აზოტის დიოქსიდამდე დისოციაციას იწვევს, ნახევარ მოლეკულურ მასად. მიღებული ცხელი აზოტის დიოქსიდი ფართოვდება ტურბინაში, აციებს მას და ამცირებს წნევას და უფრო ძალიან ცივდება თბოგამტარ ფენაზე, რაც მის უკან გადაქცევას იწვევს დიაზოტის ტეტრაოქსიდად და იბრუნებს საწყის მოლეკულურ მასას. ამ დროს ძალიან ადვილია ამ პროცესის თავიდან გამეორება. ასეთ დისოციაციურ გაზის ბრეიტონის ციკლს გააჩნია პოტენციალი საგრძნობლად გაზარდოს ელ-ენერგიის მიღების კოეფიციენტი.[8]
ქიმიური რეაქციები[რედაქტირება | წყაროს რედაქტირება]
შუალედური ნივთიერება აზოტმჟავის წარმოებისას[რედაქტირება | წყაროს რედაქტირება]
აზოტმჟავის დამზადების სამრეწველო ხერხი N2O4-ს მოიხმარს. ნივთიერება რეაქციაში შედის წყალთან და ქმნის აზოტოვანი მჟავასა და აზოტმჟავას:
- N2O4 + H2O → HNO2 + HNO3
თანაპროდუქტი HNO2 გათბობისას იშლება აზოტოვან ოქსიდად და კიდევ უფრო მეტ აზოტმჟავად. ჟანგბადთან შეხებისას NO ისევ აზოტის დიოქსიდად გარდაიქმნება:
- 2 NO + O2 → 2 NO2
შედეგად მიღებული NO2 (და რა თქმა უნდა N2O4) ციკლში თავიდან ბრუნდება აზოტოვანი და აზოტის მჟავების წარმოსაქმნელად.
მეტალის ნიტრატების სინთეზი[რედაქტირება | წყაროს რედაქტირება]
N2O4 იქცევა როგორც მარილი [NO+] [NO3−], სადაც უკანასკნელი ძლიერი მჟანგავია:
- 2 N2O4 + M → 2 NO + M(NO3)2
თუ მეტალის ნიტრატები N2O4-გან მთლიანად უწყლო გარემოში მზადდება, შედეგად შეიძლება გარდამავალ მეტალებთან რამდენიმე კოვალენტური ნიტრატის მიღებაც შეიძლება. ამის მიზეზი ნიტრატის იონის თერმოდინამიკური მისწრაფებაა ასეთ მეტალებთან იონური სტრუქტურის მაგიერ კოვალენტური ბმები წარმოქმნას. ასეთი ნივთიერებები ჩვეულებრივ უწყლო გარემოში მზადდება, რადგან ნიტრატის იონი გაცილებით სუსტი ლიგანდია, ვიდრე წყალი და თუ რეაქციის არეში წყალი მოხვდება, რეაქციის გამოსავალს მარტივი ჰიდრატირებული მარილები წარმოადგენენ. უწყლო ნიტრატები როგორც წესი კოვალენტური ნაერთებივით იქცევია და ბევრი მაგალითად უწყლო სპილენძის ნიტრატი საკმაოდ აგრესიულ ნაერთებს წარმოადგენენ ოთახის ტემპერატურის დროსაც კი. უწყლო ტიტანის ნიტრატი ვაკუუმში სუბლიმაციას სულ რაღაც 40 °C-ზე განიცდის. ბევრი გარდამავალი ჯგუფის მეტალების უწყლო ნიტრატები კაშკაშა ფერისაა. ქიმიის ეს განხრა კლიფორდ ედისონისა და ნორამნ ლოგანის მიერ იქნა შემუშავებული ნოტინჰემის უნივერსიტეტში ბრიტანეთში 1960-1970იან წლებში, როცა ხელმისაწვდომი გახდნენ მაღალეფექტური დესიკანტები და მშრალი ყუთები.
რესურსები ინტერნეტში[რედაქტირება | წყაროს რედაქტირება]
- International Chemical Safety Card 0930
- National Pollutant Inventory – Oxides of nitrogen fact sheet დაარქივებული 2004-02-05 საიტზე Wayback Machine.
- NIOSH Pocket Guide to Chemical Hazards: Nitrogen tetroxide
- Air Liquide Gas Encyclopedia: NO2 / N2O4 დაარქივებული 2016-03-10 საიტზე Wayback Machine.
- Poliakoff, Martyn. (2009)The Chemistry of Lunar Lift-Off: Our Apollo 11 40th Anniversary Special. The Periodic Table of Videos. University of Nottingham.
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ International Chemical Safety Card. დაარქივებულია ორიგინალიდან — 2005-09-08. ციტირების თარიღი: 2016-08-01.
- ↑ Henry A. Bent Dimers of Nitrogen Dioxide. II. Structure and Bonding Inorg. Chem., 1963, 2 (4), pp 747–752
- ↑ R.H. Petrucci, W.S. Harwood and F.G. Herring General Chemistry (8th ed., Prentice-Hall 2002), p.420
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ დაარქივებული ასლი. დაარქივებულია ორიგინალიდან — 2008-05-11. ციტირების თარიღი: 2016-08-01.
- ↑ Sotos, John G., MD. "Astronaut and Cosmonaut Medical Histories", May 12, 2008, accessed April 1, 2011.
- ↑ http://ntrs.nasa.gov/archive/nasa/casi.ntrs.nasa.gov/19800008230.pdf
- ↑ Ragheb, R.. Nuclear Reactors Concepts and Thermodynamic Cycles. ციტირების თარიღი: 1 May 2013.
