ქლორწყალბადმჟავა

მარილმჟავა ან ქლორწყალბადის მჟავა[1] — ქლორწყალბადის წყლის ხსნარი; ძლიერი ერთფუძიანი მჟავა. უფერო (ტექნიკური მარილმჟავა მოყვითალო ფერისაა Fe, Cl2-ის და სხვა მინარევების გამო), მას ჰაერზე «კვამლი» ასდის. მისი მაქსიმალური კონცენტრაცია მასის მიხედვით 20 °C-ის პირობებში ტოლია 38 %, ასეთი ხსნარს სიმკვრივე შეადგენს 1,19 გრ/სმ³. მოლური მასა 36,46 გრ/მოლია. მარილმჟავას მარილებს - ქლორიდებს უწოდებენ.
ფიზიკური თვისებები[რედაქტირება | წყაროს რედაქტირება]
სხვადასხვა კონცენტრაციის მარილმჟავის ხსნარების ფიზიკური თვისებები მოყვანილია ცხრილში:
| კონცენტრ. (წონა) c : კგ HCl/კგ |
კონცენტრ. (გრ/ლ) c : კგ HCl/მ³ |
სიმკვრივე ρ : კგ/ლ |
მოლურობა მოლ |
pH |
სიბლანტე η : მპა·წმ |
კუთრი თბოტევადობა s : კჯ/(კგ·К) |
ორთქლის წნევა PHCl : პა |
Т დუღილის დუღ.ტემპ. |
Т ლღვობის დნ.ტემპ. |
| 10 % | 104,80 | 1,048 | 2,87 M | −0,5 | 1,16 | 3,47 | 0,527 | 103 °C | −18 °C |
| 20 % | 219,60 | 1,098 | 6,02 M | −0,8 | 1,37 | 2,99 | 27,3 | 108 °C | −59 °C |
| 30 % | 344,70 | 1,149 | 9,45 M | −1,0 | 1,70 | 2,60 | 1,410 | 90 °C | −52 °C |
| 32 % | 370,88 | 1,159 | 10,17 M | −1,0 | 1,80 | 2,55 | 3,130 | 84 °C | −43 °C |
| 34 % | 397,46 | 1,169 | 10,90 M | −1,0 | 1,90 | 2,50 | 6,733 | 71 °C | −36 °C |
| 36 % | 424,44 | 1,179 | 11,64 M | −1,1 | 1,99 | 2,46 | 14,100 | 61 °C | −30 °C |
| 38 % | 451,82 | 1,189 | 12,39 M | −1,1 | 2,10 | 2,43 | 28,000 | 48 °C | −26 °C |
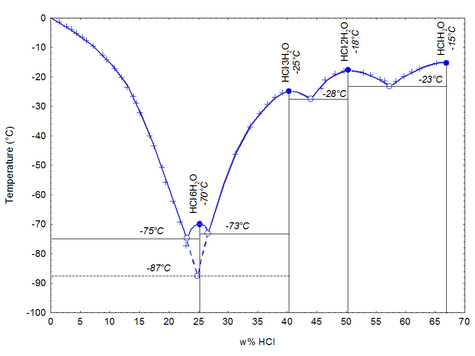
გამაგრებისას იძლევა კრისტალოჰიდრატს შემდეგი შემადგენლობით - HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
ქიმიური თვისებები[რედაქტირება | წყაროს რედაქტირება]
- ურთიერთქმედებს ლითონების ელექტრო აქტივობის რიგში წყალბადამდე მდგომ ლითონებთან მარილების წარმოქმნით და აიროვანი წყალბადის გამოყოფით:
- ურთიერთქმედებს ლითონების ოქსიდებთან მარილების ხსნარებისა და წყლის წარმოქმნით:
- ურთიერთქმედებს ლითონების ჰიდროქსიდებთან ხსნადი მარილებისა და წყლის წარმოქმნით (ნეიტრალიზაციის რეაქცია):
- ურთიერთქმედებს ლითონების მარილებთან, რომლებიც შედარებით სუსტი მჟავეებისაგან არიან წარმოქმნილნი, მაგალითად ნახშირმჟავასი:
- ურთიერთქმედებს ძლიერ მჟანგავებთან (კალიუმის პერმანგანატი, მანგანუმის დიოქსიდი) აიროვანი ქლორის წარმოქმნით:
წარმოება[რედაქტირება | წყაროს რედაქტირება]

მარილმჟავას იღებენ აიროვანი ქლორწყალბადის გახსნით წყალში. ქლორწყალბადს იღებენ წყალბადის წვით ქლორში. ლაბორატორიის პირობებში გამოიყენებენ ჯერ კიდევ ალქიმიკოსების მიერ შემუშავებულ ხერხს, სადაც ძლიერი გოგირდმჟავა ზემოქმედებს მარილებზეь:
550 °C-ზე ზევით ტემპერატურაზე და სუფრის მარილის საკმაო რაოდენობისას შესაძლებელია ურთიერთქმედება:
ქლორწყალბადი მშვენივრად იხსნება წყალში. 0 °C-ზე წყლის 1 მოცულობას შეუძლია შთანქოს ქლორწყალბადის 507 მოცულობა, რაც შეესაბამება მჟავის 45 %-იან კონცენტრაციას. თუმცა ოთახის ტემპერატურაზე ქლორწყალბადის ხსნადობა უფრო დაბალია, ამიტომაც პრაქტიკაში ჩვეულებრივ გამოიყენებენ 36%-იან მარილმჟავას.
გამოყენება[რედაქტირება | წყაროს რედაქტირება]
მრეწველობა[რედაქტირება | წყაროს რედაქტირება]
- გამოიყენება ჰიდრომეტალურგიაში და გალვანოპლასტიკაში (травление, დეკაპირება), ლითონის ზედაპირის გასასუფთავებლად რჩილვის წინ, თუთიის, მანგანუმის, რკინის და სხვა ლითონების ქლორიდების მისაღებად. ზედაპირ-აქტიურ ნივთიერებებთან ერთად გამოიყენება კერამიკული და ლითონის ნაკეთობების გასაწმენდად (აქ საჭიროა ინგიბირებული მჟავა) დაბინძურებისა და დეზინფექციისათვის.
- კვების მრეწველობაში დარეგისტრირებულია როგორც სიმჟავის რეგულატორი, საკვები დანამატი E507. გამოიყენება ზელტერის წყალის დასამზადებლად.
მედიცინა[რედაქტირება | წყაროს რედაქტირება]
- კუჭის წვენის შემადგენელი ნაწილი; გაზავებულ მარილმჟავას ადრე უნიშნავდნენ უმთავრესად ისეთი დაავადებების დროს რომლებიც კუჭის წვენის სინაკლებესთან იყო დაკავშირებული.
მოხმარების თავისებურებები[რედაქტირება | წყაროს რედაქტირება]

მარილმჟავა — კაუსტიკური ნივთიერებაა, კანზე მოხვედრისას იწვევს ძლიერ დამწვრობას. განსაკუთრებულად საშიშია თვალში მოხვედრა. ჩვეულებრივ პირობებში მარილმჟავიანი ჭურჭლის გახსნისას წარმოიქმნება ქლორწყალბადის ნისლი და ორთქლი, რომლებიც აღიზიანებენ ლორწოვან გარსს და სასუნთქ გზებს.
რეაგირებს ისეთ ნივთიერებებთან, როგორიცაა ქლორიანი კირი, მანგანუმის დიოქსიდი, ან კალიუმის პერმანგანატი, წარმოქმნის ტოქსიკურ აიროვან ქლორს.
ლიტერატურა[რედაქტირება | წყაროს რედაქტირება]
- ქართული საბჭოთა ენციკლოპედია, ტ. 6, თბ., 1983. — გვ. 442.
რესურსები ინტერნეტში[რედაქტირება | წყაროს რედაქტირება]
- «მარილმჟავა» www.xumuk.ru-ზე
- Е-507. მარილმჟავა როგორც, საკვები დანამატი
- მარილმჟავა — გამოყენება წარმოებაში. დაარქივებული 2011-11-24 საიტზე Wayback Machine.
სქოლიო[რედაქტირება | წყაროს რედაქტირება]
- ↑ მარილმჟავა საიტზე ХиМиК.ру











