ნიტროზონიუმის იონი
| ნიტროზონიუმის იონი | |
 | |
| ზოგადი | |
|---|---|
| შემოკლება | NO(+) |
| ტრადიციული სახელწოდება | იმინოოქსიდანიუმი |
| კლასიფიკაცია | |
| CAS | 14452-93-8 |
| PubChem | 84878 |
| SMILES |
|
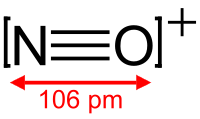
ნიტროზონიუმის იონი ფორმულით NO+, სადაც აზოტის ატომი შეერთებულია ჟანგბადის ატომთან მესამე ბმის რიგით და მთლიანად დადებით მუხტს ატარებს. ეს იონი ჩვეულებრივ მიიღება როგორც მარილები: NOClO4, NOSO4H (ნიტროზილგოგირდმჟავა (რომელიც უფრო ზუსტად ჩაიწერება ფორმულით ONSO3OH) და NOBF4. პერქლორატისა და ტეტრაფთორბორატის მარილები ოდნავ ხსნადია CH3CN-ში. NOBF4-ის გასუფთავება ხდება სუბლიმაციით 200–250 °C-ზე ვაკუუმეში.
NO+ იზოელექტრიკია CO-სთან, CN−=სთან და აზოტთან. ის მიიღება აზოტოვანი მჟავის პროტონირებით:
- HONO + H+ თარგი:Eqm NO+ + H2O
ქიმიური მახასიათებლები[რედაქტირება | წყაროს რედაქტირება]
ჰიდროლიზი[რედაქტირება | წყაროს რედაქტირება]
NO+ რეაქციაში შედის წყალთან და წარმოქმნის აზოტოვან მჟავას:
- NOBF4 + H2O → HONO + HBF4
ამ მიზეზით NOBF4 დაცული უნდა ქნეს არა მხოლოდ წყლისგან, არამედ ჰაერში არსებული ორთქლისაგან. ფუძეებთან რეაქციის პროდუქტს წარმოადგენს ნიტრიტი:
- NOBF4 + 2 NaOH → NaNO2 + NaBF4 + H2O
დიაზოტიზაციის რეაქცია[რედაქტირება | წყაროს რედაქტირება]
NO+ რეაქციაში შედის არილის ამინებთან(ArNH2) და გამოყოფს დიაზონიუმის მარილებს (ArNsub>2+). მიღებული დიაზონიუმის ჯგული (არა როგორც ამინოჯგუფი) ადვილად ნაცვლდება სხვადასხვა ნუკლეოფილებით.

როგორც მჟანგავი[რედაქტირება | წყაროს რედაქტირება]
NO+, მაგალითად NOBF4, ძლიერი მჟანგავია:[1]
- ფეროცენი/ფეროცენიუმი, [NO]+ CH2Cl2-ში ხსნარის აღმდგენი პოტენციალია 1.00 V (or 1.46–1.48 V vs SCE)
- ფეროცენი/ფეროცენიუმი, [NO]+ in CH3CN-ში ხსნარის აღმდგენი პოტენციალია 0.87 V vs. (or 1.27–1.25 V vs SCE)
მარილი NOBF4 მოასხერხებელი გამოსაყენებელია იმიტომ, რომ მისი რეაქციის თანაპროდუქტი, NO, აირია, რომელიც რეაქციის არეს აზოტის ნაკადით შეგვიძლია მოვაშოროთ. ჰაერთან შეხებისას NO წარმოქმნის NO2-ს, რომელსაც , თუ არ მოვაშორებთ, შეუძლია გამოიწვიოს მეორადი, არასასურველი რეაქციები. NO2-ს არსებობა ადვილი დასადგენია მისთვის მახასიათებელი ფორთოხლისფერი ფერით.
არენების ნიტროზილაცია[რედაქტირება | წყაროს რედაქტირება]
ელექტრონებით მდიდარი არენების ნიტროზილაცია ხდება NOBF4-ის საშუალებით.[2] ერთ-ერთი მაგალითი მოიცავს ანიზოლის გამოყენებას:
- CH3OC6H5 + NOBF4 → CH3OC6H4-4-NO + HBF4
ნიტროზონიუმი, NO+, ხანდახან ეშლებათ ნიტრონიუმში NO2+, რომელიც ნიტრირების მთავარი მოქმედი იონია. ეს ორი ნივთიერება ერთმანეთისაგან ძალიან განსხვევდებათ. ნიტრონიუმი უფრო ძლიერი ელექტროფილია, ვიდრე ნიტროზონიუმი იქიდან გამომდინარე, რომ პირველი უფრო ძლიერი მჟავიდან მიიღება (აზოტმჟავისგან), ხოლო მეორე სუსტისაგან (აზოტოვანი მჟავა).
ნიტროზილის კომპლექსების წყარო[რედაქტირება | წყაროს რედაქტირება]
NOBF4 რეაქციაში შედის ზოგიერთი მეტალის კარბონილის კომპლექსებთან და წარმოქმნის შესაბამისი მეტალის ნიტროზილის კომპლექსებს.[3] აქედან გამომდინარე, საჭიროა დავიცვათ სიფრთხილე, რომ გადავიტანოთ ელექტრონი, და არა ნიტროზონიუმის იონი [NO]+.
- (C6Et6)Cr(CO)3 + NOBF4 → [(C6Et6)Cr(CO)2(NO)]BF4 + CO
იხილეთ ასევე[რედაქტირება | წყაროს რედაქტირება]
ასევე რეკომენდირებულია[რედაქტირება | წყაროს რედაქტირება]
- ↑ N. G. Connelly, W. E. Geiger (1996). „Chemical Redox Agents for Organometallic Chemistry“. Chem. Rev. 96 (2): 877–910. doi:10.1021/cr940053x. PMID 11848774.
- ↑ E. Bosch and J. K. Kochi, "Direct Nitrosation of Aromatic Hydrocarbons and Ethers with the Electrophilic Nitrosonium Cation" Journal of Organic Chemistry, 1994, volume 59, pp. 5573–5586.
- ↑ T. W. Hayton, P. Legzdins, W. B. Sharp "Coordination and Organometallic Chemistry of Metal-NO Complexes" Chemical Reviews 2002, volume 102, pp. 935–991
