ამონიუმი: განსხვავება გადახედვებს შორის
| [შეუმოწმებელი ვერსია] | [შეუმოწმებელი ვერსია] |
No edit summary |
No edit summary |
||
| ხაზი 82: | ხაზი 82: | ||
==მჟავა-ფუძე თვისებები== |
==მჟავა-ფუძე თვისებები== |
||
ამონიუმის იონი მიიღება, როდესაც [[ამიაკი]], როგორც მცირე [[ფუძე]] თვისებების მქონე რეაქციაში შევა [[პროტონი|პროტონთან]]. |
|||
: H<sup>+</sup> + NH<sub>3</sub> → NH<sub>4</sub><sup>+</sup> |
|||
== ლიტერატურა == |
== ლიტერატურა == |
||
11:10, 16 დეკემბერი 2019-ის ვერსია
{{subst:ET|თარგის გამოყენების შეცდომა! ეს თარგი გამოიყენება subst-ის მეშვეობით. პრობლემის აღმოსაფხვრელად ჩაანაცვლეთ თარგი {{მუშავდება}} თარგით {{subst:მუშავდება}}.}}{{მუშავდება/ძირი|[[სპეციალური:Contributions/{{subst:REVISIONUSER}}|{{subst:REVISIONUSER}}]].|{{subst:CURRENTDAY}}|{{subst:CURRENTMONTH}}|{{subst:CURRENTYEAR}}}}
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | ამონიუმი აზანიუმი[1] |
| ქიმიური ფორმულა | |
| მოლური მასა | 18.039 გ/მოლი |
| ქიმიური თვისებები | |
| pKa | 9.25 |
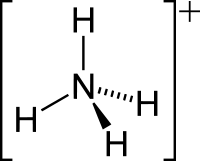
ამონიუმი — კატიონი, ქიმიური ფორმულით , შედის მრავალი ნაერთის შემადგენლობაში, სადაც ერთვალენტოვანი ლითონის როლს ასრულებს. ასეთებია ამონიუმის ჰიდროქსიდი და ამონიუმის მარილები: ამონიუმის სულფატი, ამონიუმის ქლორიდი და სხვ. ამონიუმის მარილების უმეტესობა უფერო კრისტალური, წყალში კარგად ხსნადი ნივთიერებებია, გახურებისას ადვილად იშლებიან ამიაკის გამოყოფით. წყალხსნარებში ამონიუმის ნაერთების დისოციაციის დროს ამონიუმი კატიონის სახითაა, მაგ.:
მჟავა-ფუძე თვისებები
ამონიუმის იონი მიიღება, როდესაც ამიაკი, როგორც მცირე ფუძე თვისებების მქონე რეაქციაში შევა პროტონთან.
- H+ + NH3 → NH4+
ლიტერატურა
- ქართული საბჭოთა ენციკლოპედია, ტ. 1, თბ., 1975. — გვ. 402.
სქოლიო
- ↑ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 71,105,314. Electronic version.


